|
|
|
Феромоны
Материал из Википедии — свободной
энциклопедии
Феромо́ны — собирательное название веществ — продуктов внешней
секреции, выделяемых некоторыми видами животных и обеспечивающие химическую коммуникацию между
особями одного вида. [править]История открытия
Первыми
феромоны удалось обнаружить группе немецких исследователей, которые в 1956 году сумели
выделить из желез самок шелкопряда вещество, привлекавшее самцов того же
биологического вида. Полученное вещество было названо бомбикол — из-за
латинского названия шелкопряда, Bombyx mori. [править]Классификация феромонов
Феромоны
модифицируют поведение, физиологическое и эмоциональное состояние или метаболизм других особей того же вида. Как правило,
феромоны продуцируются специализированными железами. По
своему воздействию феромоны делятся на два основных типа: релизеры и
праймеры. Релизеры — тип феромонов, побуждающих особь к каким-либо
немедленным действием и используются для привлечения брачных партнёров,
сигналов об опасности и побуждения других немедленных действий. Праймеры
используются для формирования некоторого определённого поведения и влияния на
развитие особей: например, специальный феромон, выделяемый пчелой-маткой. Это
вещество подавляет половое развитие других пчёл-самок, таким образом
превращая их в рабочих пчёл. В
качестве отдельных названий некоторых типов феромонов можно привести
следующие:
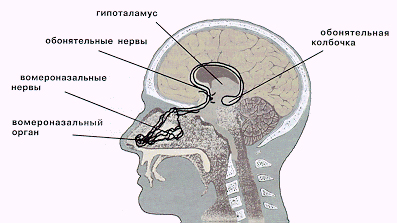
[править]Феромоны, или другими словами, половые аттрактанты - это душистые летучие вещества с небольшой молекулярной массой, выделяемые в малых количествах практически всеми представителями животного мира. Эти вещества, попадая в воздух, воспринимаются чувствительными рецепторами органов обоняния, которые передают "возбуждающий" сигнал в кору больших полушарий. (Существует дополнительный орган обоняния — вомероназальный — две крошечные трубочки, расположенные в основании носовой перегородки, вблизи косточки под латинским названием «vomer». Этот орган-малыш улавливает только феромоны — более увесистые, чем молекулы душистых веществ, пахучие вещества, через которые передается важнейшая информация.) Феромоны человека участвуют в регуляции синтеза половых и иных гормонов, а вомероназальная система непосредственно влияет на формирование мозга человеческого эмбриона. Основанные на человеческих запахах вариации природных ароматов можно с успехом использовать как средства повышения потенции, усиления чувственности, устранения проблем аноргазмии (поскольку ароматы оказывают стимулирующее действие на вомероназальный орган. Все эти ароматы, содержат «магические молекулы», которые, помимо стимуляции сексуальной сферы, являются мощными природными антидепрессантами. Они во многом определяют сексуальную привлекательность женщин и мужчин. Запахами эти феромоны практически не обладают, но действуют в очень малых количествах на рецепторы вомеронозального органа, а через него на функции, которые контролируются гипоталамусом (половое желание, половая готовность, глубокие эмоции, уровень гормонов, зрелость, агрессия или покорность и др.). 10
фактов о феромонах
1. Забытый язык. Когда-то люди в совершенстве
владели языком запахов. И хотя он давно уже нами забыт, его смысл хранит
генетическая память.
Вот скажите, почему ничем не примечательный
мужчина может показаться нам таким обаятельным? А что заставляет обходить
десятой дорогой человека, охваченного печалью или злостью? В обеих случаях
причиной являются микроскопические вещества под названием феромоны.
В отличие от богатых ароматов свежеиспеченного
пирога, «эмоциональные запахи» мы не осознаем, однако это ничуть не мешает
этим серым кардиналам тайно управлять нашей сексуальностью и настроением.
Феромоны улавливает крошечный вомероназальный
орган, расположенный в носовой перегородке, и пересылает «для перевода» в
специальный отдел головного мозга. Когда мы раздражены или плохо себя
чувствуем, испускаем репелленты. Этот запах не нравится окружающим, поэтому
они всячески стараются нас избегать. А вот ощущая душевный подъем или
уверенность в себе, мы излучаем аттраканты. И нас замечают, любят, нам
симпатизируют!
2. Нос всему голова. Читать послания феромонов
умеют 98 процентов людей. Среди них попадаются настоящие «полиглоты».
Например, слепой пианист Джордж Ширинг на запах мог определить степень
привлекательности вошедшей в комнату дамы. Многие с завязанными глазами
безошибочно отберут одежду, принадлежащую их сексуальному партнеру. А
женщины-полицейские порой отличаются столь тонким обонянием, что чувствуют
присутствие преступников по одному только… исходящему от них запаху страха.
3. Парное сочетание. Почему в одного мужчину мы
влюбляемся с первого взгляда, а другой вызывает отвращение, будь он хоть
трижды Брэд Питт! Все зависит от того, подходит ли нам запах его иммунной
системы. Мужчина со сходным иммунитетом вряд ли понравится. В нашей
генетической памяти тут же предупредительно мигнет красный сигнал опасности:
идентичный обмен веществ и генотип - не слишком удачное «наследство» для
будущего ребенка.
Кстати, по этой же причине не приветствуются браки
между родственниками. Их иммунные системы похожи, как две капли воды, и шансы
двум «бракованным» генам встретиться увеличиваются. Зато чем больше мужчина
нравится, тем сильнее его иммунотип отличается от вашего и тем лучший
генетический набор получит ребенок. Где-то в центральной Африке есть племя, в
котором до сих пор выбирают супругов по «нюху». И как утверждают
исследователи, почти никогда не ошибаются. Ну а если хотите убедиться в
правильности своего выбора, поцелуйтесь с любимым. Приятные ощущения не
пропадают? Не сомневайтесь, перед вами суженый.
4. Секрет Мэрилин Монро. Декольтированное платье,
пухлые губы, особый состав краски для волос? Вовсе нет. Люди, которые входят
в ранг секс-символов, выделяют в воздух больше половых феромонов. А те
гипнотически влияют на умы и сердца противоположного пола. Ученые полагают,
что особенно интенсивно секс-феромоны продуцируют блондинки и рыжие. Между
прочим, 10 процентов мужчин тоже имеют в своем поте вещества, которые делают
их особенно привлекательными для дам. А их рядовые собратья с весьма
заурядным набором феромонов недоумевают: почему этот коротышка Том Круз
кажется женщинам таким сексуальным?
5. Карта тела. Разумеется, каждая клеточка нашего
тела не источает феромоны. Они «обитают» на строго отведенной для них
территории. У мужчин, например, мощнейший источник феромонов — сперма.
Сексологи заметили, что у женщин, не чувствующих ее запах по причине
расстройства обоняния, страдает сексуальность. Большое количество феромона
андростерона выделяется вместе с потом. Источником феромонов является кожа,
волосы и подмышечные впадины — причем как у мужчин, так и у женщин. А самый
мощный женский феромон — копулин — присутствует в выделениях вагины. Не
случайно во многих восточных школах, практикующих науку любви, женщинам
советовали вместо духов пользоваться… насыщенными феромонами «соками тела».
6. Ароматы любви. Самое простое приворотное
средство — это духи, обогащенные половыми аттракантами. Купить такое «зелье»
можно в любом секс-шопе. Но знаете ли вы, что и обычный парфюм, безо всяких
«привораживающих» добавок, тоже может усилить собственное очарование!
Ненавязчивый и окутывающий вас, который хочется вдыхать до бесконечности, он
усиливает сигналы, посылаемые вами потенциальному спутнику жизни. Но не злоупотребляйте
духами -- громкий хор их многочисленных композиций заглушает тоненький
голосок феромонов.
Чтобы пробудить в себе чувственность и усилить
выработку собственных половых феромонов, придуманы смеси-афродизиаки:
Для светловолосых. Смешайте сухие травы: 6
лепестков розы, столько же лепестков фиалки, по щепотке мяты и шалфея, 10
листьев вербены. Залейте 50 мл спирта и настаивайте неделю. Затем процедите.
Наносите на запястья и под колени, лучше всего после захода солнца.
Для темноволосых. В 50 мл спирта добавьте одну
чайную ложку цветов сирени, по капле эфирного масла гвоздики и жасмина. В
другую емкость с таким же количеством спирта бросьте по щепотке мяты и
базилика. Настаивайте неделю. Когда настой будет готов, наносите на запястья
по одной капле первого состава, а сверху — по капле другого. Лучше всего, по
утверждениям знатоков, «зелье» действует до полудня.
7. Школа обольщения. Если хотите понимать язык
феромонов, дышите не ртом, а носом. Причем ученые считают, что особенно
чувствительна к феромонам левая ноздря. Не сидите на строгих диетах. Иначе
организм начнет выводить через поры продукты распада белков, и кожа
приобретает специфический запах. А усиленное выделение репеллентов
красноречиво поведает окружающим об эмоциональном спаде, неизбежно сопровождающем
жертву инквизиторских диет.
8. Феромон в чистом виде. Собираясь повышать свою
сексуальность, будьте осторожны с антиперспирантами. Особенно перед
свиданием. Они приостанавливают процесс потоотделения, а вместе с ним и
выработку феромонов. Правда, впадать в другую крайность тоже не стоит. Резкий
запах пота создает серьезные помехи сексуальным посланиям, к тому же не всем
мужчинам нравится столь «жесткий натурализм». Как сказал один древнеримский
мудрец: «Лучшим ароматом женщины является естественный запах, когда от нее
ничем больше не пахнет».
9. В зачаточной форме. Мужчинам легко определить,
когда у женщины наступает наиболее благоприятный период для зачатия. Дело в
том, что при овуляции у нее меняется состав феромонов. Мужчины это чувствуют
и подсознательно у них возникает порыв подарить даме сердца, например, цветы.
Женщины тоже меняют стиль поведения. Они хотят флиртовать, носить откровенные
наряды. Существует и наглядный признак «готовности»: в этот период кожа как
бы слегка светлеет, а груди становятся более симметричными.
10. Секретное оружие. Ученые стали изучать
феромоны совсем недавно. Всего их было открыто 20, и большинство из них к
сексуальным ароматам никакого отношения не имеют. Со временем
«привораживающие» стали использовать в парфюмерии. А остальные… соблюдая
строжайшую конспирацию, изучают секретные службы. Ведь с помощью
микроскопических доз пахучих молекул можно манипулировать сознанием и
поведением человека.
Говорят, последние разработки связаны с
воздействием феромонов на память и внушение. Если в секретных лабораториях
расшифруют индивидуальный запах человека, то сильно облегчат жизнь
следователям: преступника можно будет вычислить за считанные минуты по
личному «отпечатку запахов».
А как пригодились бы феромоны в медицине! Врачи
могли бы использовать их в лечении гормональных нарушений. Кстати, уже
доказано, что запах мужского пота, насыщенного феромонами, не только улучшает
настроение женщин, но и способен… менять уровень гормона, регулирующего
репродуктивную функцию.
Для многих из нас запах тела чернокожих кажется
слишком резким. А вот для представителей монголоидной расы «бледнолицые»
пахнут просто невыносимо.
По материалам журнала «Натали»
Феромоны насекомых
Феромоны
используются насекомыми для подачи самых разных сигналов. Упомянутый
во вступлении к статье бомбикол использовался самками шелкопряда для поиска
полового партнёра, однако на этом влияние феромонов на регулирование жизни
насекомых не ограничивается. Например,
муравьи используют феромоны для обозначения пройденного
пути. По специальным меткам, оставляемым по дороге, муравей может найти
дорогу обратно в муравейник. Также, метки, делаемые при помощи феромонов
показывают муравейнику путь к найденной добыче. Отдельные запахи используются
муравьями для подачи сигнала об опасности, что провоцирует у особей либо
бегство, либо агрессивность. [править] Феромоны позвоночных
Ввиду
достаточно сложных поведенческих реакций феромоны позвоночных изучены слабо. Существует предположение,
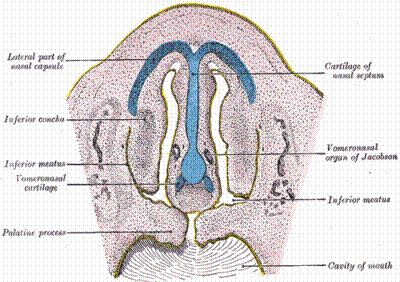
что рецептором феромонов у позвоночных является вомероназальный (якобсонов) орган. Исследование
человеческих феромонов находится пока ещё на зачаточной стадии. Известно, что
в поте
некоторых мужчин находятся вещества, привлекающие женщин. Также
отмечено, что в больши́х женских коллективах менструальный цикл со
временем синхронизируется, протекая одновременно у большинства женщин. Эта
особенность также приписывается воздействию человеческих феромонов. [править] Применение феромонов
Феромоны
нашли своё использование в сельском хозяйстве. В сочетании с ловушками разных
типов, феромоны, приманивающие насекомых, позволяют уничтожать значительные
количества вредителей. Также, распыление феромонов над охраняемыми
сельскохозяйственными угодьями позволяет обмануть самцов вредителей и таким
образом снизить популяцию вредных насекомых — ввиду того, что самцы,
привлечённые более сильным синтетическим запахом, не смогут найти самку для
спаривания. Многие феромоны насекомых ученые научились синтезировать
искусственно. СЛАДКАЯ ВЛАСТЬ
ФЕРОМОНОВ Кандидат
биологических наук А. МАРГОЛИНА http://www.nkj.ru/archive/articles/1243/ Представьте, что вы голодны - не
так чтобы очень сильно, но мысль о еде все настойчивее вас посещает. И вдруг
доносится восхитительный аромат чего-то жареного. Моментально, словно кто-то
нажал невидимую кнопку, рот наполняется слюной, желудок "подает
голос", а чувство голода становится нестерпимым. Проследить связь между
запахом и физиологической реакцией (слюноотделение, выделение желудочных
соков) в данном случае несложно, однако стоит убрать запах (вернее, осознанную
регистрацию запаха), и все происходящее станет совершенно непонятным. Нечто там, в носу
...О чудеса природы! О
нос!...
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Abstract |
We observed the surface of the anterior part of the nasal septum of
living subjects using an endoscope. In ~13% of 1842 patients without
pathology of the septum, the vomeronasal pit was clearly observed
on each side of the septum, and in 26% it was observed only on one
side. The remaining observations indicated either the presence of
putative pits or no visible evidence of a pit. However, repetitive
observations on 764 subjects depicted changes over time, from
nothing visible to well-defined pits and vice versa. Based on 130
subjects observed at least four times, we estimate that ~73% of
the population exhibits at least one clearly defined pit on some
days. By computer tomography, the vomeronasal cavities were
located at the base of the most anterior part of the nasal septum.
Histological studies indicated that the vomeronasal cavities
consisted of a pit generally connected to a duct extending in a
posterior direction under the nasal mucosa. Many glands were
present around the duct, which contained mucus. There was no sign
of the pumping elements found in other mammalian species. Most
cells in the vomeronasal epithelium expressed keratin, a protein
not expressed by olfactory neurons. Vomeronasal epithelial cells
were not stained by an antibody against the olfactory marker
protein, a protein expressed in vomeronasal receptor neurons of
other mammals. Moreover, an antibody against protein S100, expressed
in Schwann cells, failed to reveal the existence of vomeronasal
nerve bundles that would indicate a neural connection with the
brain. Positive staining was obtained with the same antibodies on
specimens of human olfactory epithelium. The lack of neurons and
vomeronasal nerve bundles, together with the results of other
studies, suggests that the vomeronasal epithelium, unlike in other
mammals, is not a sensory organ in adult humans.
|
|
Introduction |
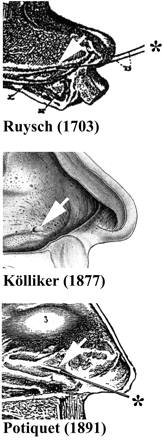
Frederic Ruysch discovered the vomeronasal cavities in humans in
1703 (Figure 1A). He described a ‘canalibus
nasalibus’ on each side of the anterior part of the nasal septum
of a young cadaver (Figure 1A) (Ruysch, 1703![]() ; Hollnagel-Jensen and Andreasen,
1948
; Hollnagel-Jensen and Andreasen,
1948![]() )]. Von Sömmering (Von
Sömmering, 1809
)]. Von Sömmering (Von
Sömmering, 1809![]() ) confirmed these
observations on adult cadavers and Kölliker (Kölliker, 1877
) confirmed these
observations on adult cadavers and Kölliker (Kölliker, 1877![]() ) (Figure 1B) made a detailed study of the
position of the vomeronasal cavities in the nasal septum of dead foetuses,
children and adults. In 18 adults he found these cavities
) (Figure 1B) made a detailed study of the
position of the vomeronasal cavities in the nasal septum of dead foetuses,
children and adults. In 18 adults he found these cavities ![]() ) extended these observations to
living adults. By inserting a fine stylet into visible pits (Figure 1C), he estimated the
length of the cavity to be 3–4 mm. He observed both sides of the
nasal septum of 200 living subjects and found only 100 pits, i.e.
they were present in only 25% of the observed nasal cavities.
Ludvig Jacobson described in great detail the vomeronasal organ in
a number of mammalian species [Jacobson,
) extended these observations to
living adults. By inserting a fine stylet into visible pits (Figure 1C), he estimated the
length of the cavity to be 3–4 mm. He observed both sides of the
nasal septum of 200 living subjects and found only 100 pits, i.e.
they were present in only 25% of the observed nasal cavities.
Ludvig Jacobson described in great detail the vomeronasal organ in
a number of mammalian species [Jacobson, ![]() )]. He also noted the lack
of development of the vomeronasal structure in humans and said
that the vomeronasal organ could be ‘a sensory organ which is a
sense about which human beings have no conception’. More recently,
Johnson et al. observed 100 living adults and found a
vomeronasal pit either on both sides (nine subjects) of the nasal
septum or only one side (30 subjects) (Johnson et al., 1985
)]. He also noted the lack
of development of the vomeronasal structure in humans and said
that the vomeronasal organ could be ‘a sensory organ which is a
sense about which human beings have no conception’. More recently,
Johnson et al. observed 100 living adults and found a
vomeronasal pit either on both sides (nine subjects) of the nasal
septum or only one side (30 subjects) (Johnson et al., 1985![]() ). In histological sections from
cadavers they identified at least one vomeronasal cavity in ~70%
of nasal septa. Gaafar et al. observed vomeronasal pits in ~76%
of subjects (Gaafar et al., 1998
). In histological sections from
cadavers they identified at least one vomeronasal cavity in ~70%
of nasal septa. Gaafar et al. observed vomeronasal pits in ~76%
of subjects (Gaafar et al., 1998![]() ). Other studies (Garcia-Velasco
and Mondragon, 1991
). Other studies (Garcia-Velasco
and Mondragon, 1991![]() ; Moran et al., 1991
; Moran et al., 1991![]() ; Stensaas et al., 1991
; Stensaas et al., 1991![]() ) claim that most
adults have visible bilateral vomeronasal pits, but do not give
many details about the criteria used for identification. In a
previous study (Trotier et al., 1996
) claim that most
adults have visible bilateral vomeronasal pits, but do not give
many details about the criteria used for identification. In a
previous study (Trotier et al., 1996![]() ), we observed the vomeronasal
pits in a few subjects. One aim of the present study was to obtain
a better estimate of the prevalence of vomeronasal pits using a
larger population.
), we observed the vomeronasal
pits in a few subjects. One aim of the present study was to obtain
a better estimate of the prevalence of vomeronasal pits using a
larger population.
A central question concerning the vomeronasal structure in adult humans
is its functionality. If the vomeronasal cavity were to act, like
in other mammals, as a sensory organ bringing information to the
brain it must contain receptor neurons. However, to our knowledge,
the evidence for functional vomeronasal receptor neurons connected
to the brain is very inconclusive in adult humans. Attempts to
demonstrate the existence of neurons, in adult vomeronasal
epithelia, were negative (Jordan, 1973![]() ; Johnson et al.,
1985
; Johnson et al.,
1985![]() ; Moran et al., 1991
; Moran et al., 1991![]() ; Johnson, 1998
; Johnson, 1998![]() ; Smith et al., 1998
; Smith et al., 1998![]() ), except in one study (Takami
et al., 1993
), except in one study (Takami
et al., 1993![]() ) where a few epithelial
cells, having a bipolar shape, were stained with an antibody
against neuron-specific enolase. However, the density of these
putative sensory neurons did not exceed a few immunoreactive cells
per 200 µm of vomeronasal luminal surface. Electron microscopy
studies of adult vomeronasal ducts (Stensaas et al., 1991
) where a few epithelial
cells, having a bipolar shape, were stained with an antibody
against neuron-specific enolase. However, the density of these
putative sensory neurons did not exceed a few immunoreactive cells
per 200 µm of vomeronasal luminal surface. Electron microscopy
studies of adult vomeronasal ducts (Stensaas et al., 1991![]() ; Gaafar et al., 1998
; Gaafar et al., 1998![]() ; Jahnke and Merker, 1998
; Jahnke and Merker, 1998![]() ) also suggest that
some epithelial cells could be considered as putative neurons, but
arguments are indirect and not conclusive. It seems essential that
more information must be obtained before drawing a definite conclusion
about the sensory function of the vomeronasal epithelium in adult
humans.
) also suggest that
some epithelial cells could be considered as putative neurons, but
arguments are indirect and not conclusive. It seems essential that
more information must be obtained before drawing a definite conclusion
about the sensory function of the vomeronasal epithelium in adult
humans.
|
|
Materials and methods |
Observations with the endoscope
We
observed both sides of the nasal septum of 1154 women and 877 men.
All age groups (Table 1) were represented for both genders
(15–94 years; mean age = 46 ± 17 years for men and 49 ± 16 years
for women). The endoscope used was a Storz Foreward Endoscope 0°,
Table 1 Age structure of the population of 2031
subjects observed by endoscopy
|
Age (years) |
Women |
Men |
|
|
||
|
15–24 |
79 |
103 |
|
25–34 |
182 |
154 |
|
35–44 |
186 |
151 |
|
45–54 |
268 |
170 |
|
55–64 |
238 |
164 |
|
64–74 |
156 |
99 |
|
>74 |
45 |
36 |
|
Total |
1154 |
877 |
For each subject the diagnostic of a possible pathology of the nasal
mucosa was established using appropriate clinical methods. Subjects
were gathered into the following four etiological groups: (i) no
pathology (n = 773); (ii) presence of nasal polyps (n =
402); (iii) inflammation of the mucosa due to allergy or rhinitis (n
= 667); and (iv) altered nasal septum due to perforation or
surgical modification of the anterior part of the nasal septum (n
= 189). Subjects from groups 1, 2 and 3 did not have an altered nasal
septum (n = 1842). Statistical analysis was performed using
the ![]() 2 test. Means are given ± 1 SD.
2 test. Means are given ± 1 SD.
Computer tomography
The
nasal cavities of seven patients (five males and two females; mean
age 48 years, range 15–63 years) were examined using computer
tomography after filling of the vomeronasal cavity with Iopamiron
370® (a tri-iodine water-soluble contrast substance commonly used
in radiology; Sherring-Plough, UK). For these subjects nasal
computer tomography was prescribed for medical reasons not related
to the pathology of the nasal septum. All subjects were informed
and gave their consent to this observation. The contrast substance
was injected using a sterile catheter (Venflon, 100 µm in
diameter,
Consecutive
Histology
Specimens
were collected from four fresh cadavers of subjects who have
consented to post-mortem scientific studies and from 11 patients
undergoing a surgical procedure that required a large ablation of
the tissues at the anterior part of the nasal septum. The
ablation, performed by a surgeon on patients under general
anaesthesia, was necessary for medical reasons not related to the
present study. According to the recommendations from the
Declaration of Helsinki, subjects were informed about the procedure
and gave their consent. Specimens of nasal epithelium were fixed
in buffered 3% formaldehyde or Bouin’s fixative for 2 days,
dehydrated and embedded in paraffin. Serial sections (4 µm thick)
were made and stained with haematoxylin–eosin and saffron. Of the
15 specimens, nine contained a vomeronasal structure. Seven of
these were subsequently processed using various antibodies.
Immunohistochemistry
Antibodies
specific for keratin (Immunotech KL1, Marseille, France, dilution
1/50), neuron-specific enolase (Dako H14, Glostrup, Denmark,
dilution 1/100), olfactory marker protein (OMP; a gift of Prof.
Frank L. Margolis, University of Maryland, Baltimore, MD; dilution
1/600), S-100 protein (Dako Z311, polyclonal; dilution 1/500),
chromogranin A (Dako DakA3; dilution 1/100), synaptophysin (Dako
SY 38; dilution 1/20; after microwave pre-treatment of sections),
tau protein (Dako A024, polyclonal; dilution 1/200), neurofilaments
(Immunotech 1065; no dilution) and vimentin (Immunotech V9;
dilution 1/50) were used. After incubation, the fixation of the
antibody was revealed using an avidin–biotin complex peroxidase
method (Vectastain ABC kit, Vector Lab, Burlingam, CA). Several
slides at different levels of each vomeronasal structure were
incubated with each antibody. All the slides were counterstained
with haematoxylin. For all antibodies, simultaneous processing of
serial sections of adult human olfactory mucosa was performed.
Omission of the primary antibody was used as a negative control in
each case.
|
|
Results |
Endoscopy
Well-defined pits
In some cases the vomeronasal pit was found almost immediately when
looking at the antero-inferior one-third of the nasal septum with
the endoscope. It appeared as an obvious depression into the nasal
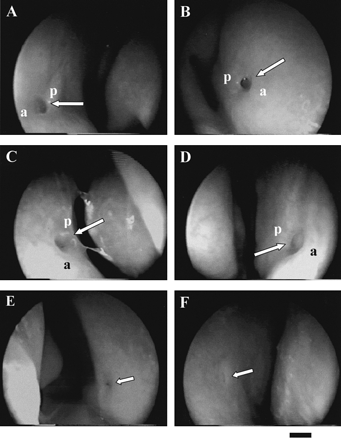
mucosa (Figure 2A–D). The size of these pits ranged
from ~1 mm to ~2.5 mm. In most of these cases, the posterior edge
(p in Figure 2) of the pit dropped much more
rapidly into the nasal mucosa than the anterior edge (a in Figure 2) and made a
well-defined ridge, with a crescent or rounded shape. For over
half of these observations the opening of the internal duct (see
below) was clearly seen. Carbon particles, when applied around the
pit, moved over the pit, transported by the flow of mucus that
moved in an antero-posterior direction. Suggestively, the mucus
did not specifically converge towards the pit.
|
In other cases (Figure 2E) the pit was also well defined
but smaller, down to ~0.3 mm. Most of the time, these small pits
became apparent only after clearing the mucus layer with a cotton pad.
Putative pits
Sometimes, well-defined pits were not found but the presence of
putative pits (Figure 2F) was suspected in the expected
region of the septum. These putative pits, of ~1–2 mm in diameter,
appeared as being nearly flush with the surface. No clear depression
into the nasal mucosa could be seen and the posterior edge was not
visible.
Absence of visible pit
In many cases nothing similar to a pit or a putative pit could be
seen at the surface of one or both sides of the nasal septum, despite
a thorough cleaning of the mucus and a careful observation of the
said region of the septum. In these cases the area of observation
was extended to all the observable surface of the septum.
|
Left
side |
Right
side |
Group
1 (no pathology) |
Group
2 (polyposis) |
Group
3 (allergy/rhinitis) |
Total
(groups 1–3) |
Group
4 (altered septum) |
|
|
||||||
|
1 |
1 |
104
(13.5%) |
64
(15.9%) |
76
(11.4%) |
244
(13.2%) |
3
(1.6%) |
|
1 |
0 |
69
(8.9%) |
31
(7.7%) |
37
(5.5%) |
137
(7.4%) |
3
(1.6%) |
|
1 |
? |
43
(5.6%) |
27
(6.7%) |
40
(6.0%) |
110
(6.0%) |
2
(1.1%) |
|
0 |
1 |
59
(7.6%) |
39
(9.7%) |
44
(6.6%) |
142
(7.7%) |
7
(3.7%) |
|
? |
1 |
33
(4.3%) |
22
(5.5%) |
32
(4.8%) |
87
(4.7%) |
7
(3.7%) |
|
0 |
0 |
320
(41.4%) |
163
(40.5%) |
307
(46.0%) |
790
(42.9%) |
149
(78.8%) |
|
0 |
? |
54
(7.0%) |
27
(6.7%) |
46
(6.9%) |
127
(6.9%) |
6
(3.2%) |
|
? |
0 |
56
(7.2%) |
20
(5.0%) |
57
(8.5%) |
133
(7.2%) |
10
(5.3%) |
|
? |
? |
35
(4.5%) |
9
(2.2%) |
28
(4.2%) |
72
(3.9%) |
2
(1.0%) |
|
Total |
|
773 |
402 |
667 |
1842 |
189 |
|
|
||||||
Prevalence of pits and putative pits
For each subject we noted, for each side of the nasal septum, ‘1’ when
a pit was present, ‘?’ when a putative pit was present and ‘0’
when no vomeronasal pit could be observed. Considering the left
and the right sides of the septum and the three possibilities
(presence of a pit, presence of a putative pit or nothing visible),
nine classes of subjects were observed. Table 2 indicates the number of subjects
in each of these classes for 773 subjects without nasal pathology,
402 subjects having nasal polyps and 667 subjects showing an inflammation
of the nasal mucosa due to allergy or rhinitis. Analysis of the
results described in Table 2 also indicates that
these two pathological groups and the reference group are homogeneous
(![]() 2 = 0.15). Therefore we pooled these three
groups to give an
2 = 0.15). Therefore we pooled these three
groups to give an
Table 2 Aspects of the vomeronasal pits at the first observation of
the left and right sides of the nasal septum of 2031 subjects
estimation
of the prevalence of the pits in 1842 subjects. It is evident from
Table 2 that less than half of the
subjects (42.9%) had no visible pit on either side of the septum
at a single observation.
In the first step of analysis, we
considered only the prevalence of clearly defined pits (such as in
Figure 2A–E). Putative pits
were not considered. In that case, one can observe that 244
subjects (13.2%) had a pit on each side of the septum, 247 subjects
(13.4%) had a pit only on the left and 229 subjects (12.4%) had a
pit only on the right. About 39% of our sample showed at least one
well-defined vomeronasal pit.
In
the second step, we included putative pits. In that case, 513
subjects (27.9%) had bilateral pits, 270 subjects (14.7%) had a
pit only on the left and 269 subjects (14.6%) a pit only on the
right. About half of the population (57%) had at least one
well-defined pit or one putative pit. No statistical difference (2
test) was observed when we considered the sex of the subjects. Analysis
made after repartitioning the subjects into classes of 10 years
age range revealed that there were no changes in frequency of the
vomeronasal pit with age.
The
probability of observing a pit, or a putative pit, in 189 patients
with an altered septum due to either nasal perforation or surgery
of the nasal septum was significantly lower (![]() 2 < 0.01) than for the group of
1842 reference subjects (Table 2). Most of them (73.4%)
had no visible vomeronasal pit on either side of the septum, 6.9%
had bilateral pits and the remaining (19.7%) had only one pit
either on the left or on the right side.
2 < 0.01) than for the group of
1842 reference subjects (Table 2). Most of them (73.4%)
had no visible vomeronasal pit on either side of the septum, 6.9%
had bilateral pits and the remaining (19.7%) had only one pit
either on the left or on the right side.
Repetition of the observations
We had the opportunity to repeat the observation of the nasal septum
on 764 subjects without any pathology of the nasal mucosa. The
time between the observations ranged from a few days to a few
months. No statistical difference (![]() 2 = 0.30) was observed between the
frequencies observed in the nine classes of Table 2 in the first and the second series,
indicating a global stability of the observations at the level of
the whole population of subjects. However, there was a variability
of the observations for some subjects. Two features were noted. A
vomeronasal pit observed on the first inspection could not be
observed on the second inspection. Conversely, a vomeronasal pit
could be observed on the second inspection where nothing could be
seen on the first inspection. More precisely, only 65.3% of the
observations remained constant between the two observations. Of
414 well-defined pits visible in the first series, 52 (12.6%)
became putative pits and 54 (13.0%) were no longer visible in the
second series. One hundred and sixty pits appeared in the second
series from 255 putative pits and from no detectable pit (n
= 859) in the first series. Of the 255 putative pits seen in the
first series, 194 were no longer visible and 69 became
well-defined pits. Ninety-one pits appeared from no detectable pit
in the first inspection. Following these observations, it is clear
that the appearance of the vomeronasal pit could change over time
for a given subject. In 130 subjects seen four times or more, at
least one vomeronasal pit could be observed in 95 subjects (73.1%)
and at least a putative pit could be observed on at least one side
in an additional 24 subjects (18.5%). No pit or putative pit could
be detected on either side of the septum in only 11 subjects
(8.5%).
2 = 0.30) was observed between the
frequencies observed in the nine classes of Table 2 in the first and the second series,
indicating a global stability of the observations at the level of
the whole population of subjects. However, there was a variability
of the observations for some subjects. Two features were noted. A
vomeronasal pit observed on the first inspection could not be
observed on the second inspection. Conversely, a vomeronasal pit
could be observed on the second inspection where nothing could be
seen on the first inspection. More precisely, only 65.3% of the
observations remained constant between the two observations. Of
414 well-defined pits visible in the first series, 52 (12.6%)
became putative pits and 54 (13.0%) were no longer visible in the
second series. One hundred and sixty pits appeared in the second
series from 255 putative pits and from no detectable pit (n
= 859) in the first series. Of the 255 putative pits seen in the
first series, 194 were no longer visible and 69 became
well-defined pits. Ninety-one pits appeared from no detectable pit
in the first inspection. Following these observations, it is clear
that the appearance of the vomeronasal pit could change over time
for a given subject. In 130 subjects seen four times or more, at
least one vomeronasal pit could be observed in 95 subjects (73.1%)
and at least a putative pit could be observed on at least one side
in an additional 24 subjects (18.5%). No pit or putative pit could
be detected on either side of the septum in only 11 subjects
(8.5%).
Computer tomography
To
get more detailed information about the position of the vomeronasal cavities
in the nasal septum, we injected a water-soluble contrast substance
into clearly visible pits of seven subjects. Computer tomography
scans were performed ~15 min after the injection, and coronal,
sagittal and axial sections of the nasal cavities were
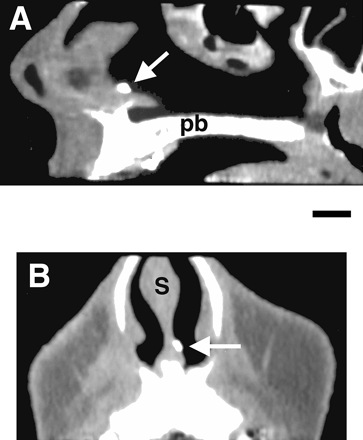
reconstructed (Figure 3). The location of the opaque spot
indicated the position of the vomeronasal cavity. Its length ranged
from 2 to
|
Connection of the pit with the vomeronasal duct
One
of the longest vomeronasal ducts that we observed is presented in Figure 4. In this preparation the sections
were made along a plane parallel to the long axis of the duct and
perpendicular to the surface of the nasal mucosa. Therefore, both
the medial side and the lateral side of the duct were observed
simultaneously. In other mammals, the epithelium of the medial side
contains vomeronasal neurons and the lateral side is lined with
ciliated epithelium on a structure containing erectile tissue and
blood vessels, which are involved in the active pumping of the
stimuli into the lumen.
|
In Figure 4, the vomeronasal pit, in direct contact
with the nasal cavity, appeared as a funnel. The diameter and the
depth of the pit was ~600 µm. The posterior edge (p in Figure 4) of the pit deepened
rapidly into the nasal mucosa. The vomeronasal duct started at the
base of this posterior edge. Adjacent serial sections indicated
that the duct was closed, at its posterior end, after a length of
~2 mm. The lumen of the duct had a diameter of ~100 µm and contained
mucus. Many glands (arrows in Figure 4) were present on both sides of
the duct, below the epithelium lining the lateral and medial sides
of the lumen. The duct of some of these glands clearly reached the
surface of the epithelium (g in Figure 4).
In
contrast to other mammals (see Døving and Trotier, 1998![]() ), there was no sign of any
erectile tissue, large blood vessels or encapsulating cartilage
around the duct.
), there was no sign of any
erectile tissue, large blood vessels or encapsulating cartilage
around the duct.
Five
other specimens contained a similar vomeronasal structure although
the length of the duct was sometimes smaller than in Figure 4. In three additional specimens
the pit was present but the duct was very short or absent. In six
other specimens nothing similar to a vomeronasal structure could
be found.
Immunohistochemistry
Anti-keratin
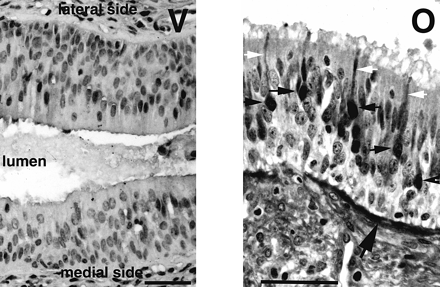
In the olfactory epithelium (Figure 5, O) keratin was found in
supporting cells, located in the upper part of the epithelium, and
in cells located near the basal lamina. Bipolar olfactory receptor
neurons were not reactive and therefore their cell bodies made a
distinctive unstained layer in the lower half of the epithelium.
No such clear layer could be observed in sections of vomeronasal
ducts (Figure 5, V). The majority of cells
were stained with no obvious difference between the epithelium covering
the lateral side of the lumen and the epithelium covering the
medial side. Some epithelial cells were not stained, but they did
not form a clear layer in the epithelium. Among them, very rare
cells had a morphology that could evoke the typical bipolar shape
of vomeronasal neurons observed in all other species. It should be
emphasized that the density of these ‘bipolar cells’ was extremely
low. For example, only one cell, indicated by the arrow in Figure 5 (V) and shown in negative at
higher magnification in the picture on the right, was found in
this section of the epithelium covering the medial side of the
lumen.
|
The same observations were made from five out of the six other specimens
of vomeronasal structures; the last one was not tested.
Anti-OMP
The antibody against the olfactory marker protein stained the cytoplasm
of olfactory receptor neurons in the olfactory epithelium (Figure 6, O). These cells had a typical
bipolar shape with a long dendrite reaching the surface of the
epithelium. The same antibody applied in the same conditions
failed to stain any cell in the vomeronasal epithelium, either in
the medial epithelium or in the lateral epithelium (Figure 6, V).
|
We tested this antibody on the six other vomeronasal specimens. In
none of them could we reveal the presence of OMP-expressing cells in
the epithelia. In two specimens, glands below the epithelium were
stained.
Anti-protein S-100
The S-100 protein is a marker expressed in glial and Schwann cells
wrapping axon fascicles. Myoepithelial cells and some duct cells
of normal seromucous glands also express S-
|
This antibody was tested on five out of the six other vomeronasal specimens
(one specimen was not tested). In none of them could staining of
nerve bundles be observed.
Anti-neuron-specific enolase
This antibody stained a number of receptor neurons in the olfactory epithelium
(not shown). In four out of the seven vomeronasal structures no
staining was observed. In the remaining three specimens, a very
few epithelial cells were reactive to the antibody (not shown).
Other antibodies
Other antibodies, against vimentin, neurofilaments, glial fibrillary acidic
protein, synaptophysin, chromogranin A and tau-protein, were not
reactive either in olfactory epithelium or in the seven vomeronasal
structures.
|
|
Discussion |
Anatomy of the vomeronasal pits
In
the present study, we confirm that the opening of the vomeronasal structure
can be observed in many subjects. In some cases it made a clearly
defined depression in the nasal mucosa. The injection of a
contrast substance, followed by computer tomography, indicated that
the vomeronasal cavity was located in the enlargement seen at the
base of the nasal septum. This is exactly the position of the
vomeronasal organ in human embryos (Kjær and Fischer Hansen,
1996a). This observation is significant
because Johnson et al. showed that many small pits observed
by endoscopy to be distributed across large areas of the septum
were, in fact, the openings of glands (Johnson et al., 1985).
We
found that the antero-posterior position of the vomeronasal duct,
in computer tomographies, corresponds well with previous observations
(Figure 1) and more recent findings
(Jordan, 1973; Johnson et al.,
1985), ~2 cm from the nostril.
Originally
discovered by Ludvig Jacobson (Trotier and Døving, 1998), a cartilaginous capsule
separates, in all other mammals, the vomeronasal organ from the
nasal cavity. We did not observe such cartilage around the duct in
adult humans, which agrees with previous observations (Potiquet,
1891; Johnson et al., 1985). In addition, other mammals use
a special device, consisting of a turgescent tissue irrigated by
large and small blood vessels, to pump in and out the stimulus
present in the nasal cavity (Døving and Trotier, 1998). These elements were not
discernible in our histological material. This lack of pumping
elements has already been emphasized (Johnson et al., 1985; Jordan, 1973). We agree with
Jacobson (Trotier and Døving, 1998), who considered that
the vomeronasal structure is rudimentary or regressive in adult
humans. In a few attempts we observed, during a few minutes, that
the flow of nasal mucus was not obviously directed towards or from
the pit. Therefore one should consider that substances in the nasal
mucus might reach the vomeronasal duct only by passive diffusion.
Inspection
of the nasal septum of a given individual led to three possible
observations concerning the vomeronasal pit: the presence of a
well-defined pit, the presence of a putative pit or no pit
visible. An intriguing outcome of the present study is that the
appearance of the pit may change for a given individual depending
on the time of observation. In some cases, repetition of the
observation indicated that well-defined pits appeared where only
putative pits or even no visible pits were observed in the first
inspection. Therefore one cannot conclude the absence of a pit
when nothing is visible from a single observation; repeated
observations at different times are required. If we consider the
130 subjects observed at least four times, we can conclude that
~73% of them presented a well-defined pit on one day or another.
This percentage increases to ~91% if we consider putative pits.
A
well-defined pit may also change into a ‘putative’ pit or ‘no
visible’ pit during successive inspections. These observations
suggest the existence of an unknown mechanism that may change the
appearance of the pit and therefore reduces the possibility of
seeing it by endoscopy. In this context it is of interest that
Pearlman says: ‘Seeing the facility with which the opening of the
organ can be found in the cadaver, it is astonishing how difficult
it is to find it in the living subjects’ (Pearlman, 1934![]() ). Johnson et al. made
similar observations: in living subjects they observed that 39
nasal septa out of 100 presented at least one visible pit, whereas
histological observation from cadavers indicated that ~70% of nasal
septa presented at least one vomeronasal pit (Johnson et al.,
1985
). Johnson et al. made
similar observations: in living subjects they observed that 39
nasal septa out of 100 presented at least one visible pit, whereas
histological observation from cadavers indicated that ~70% of nasal
septa presented at least one vomeronasal pit (Johnson et al.,
1985![]() ).
).
The
probability of finding a pit or a putative pit does not depend on
obvious pathology of the nasal mucosa, such as polyposis, rhinitis
or allergy. It is only when the anterior part of the septum was
altered by perforation or surgical septoplasty that the
probability of finding pits was significantly lower. No significant
effect of age or sex was observed.
Histology of the vomeronasal epithelium
There
have been few electrophysiological studies aimed at revealing nervous
activity of the vomeronasal cavity in humans. A negative shift of
the surface potential of the pit was recorded following application
of putative human pheromones (Monti-Bloch and Gosser, 1991![]() ; Monti-Bloch et al., 1994
; Monti-Bloch et al., 1994![]() ). By analogy with the slow
voltage change evoked by odorants at the surface of the olfactory
epithelium, this electrical signal has been considered by the
authors as the receptor potential induced by activation of
vomeronasal receptor neurons. According to this interpretation,
the activation of the vomeronasal pit may trigger autonomic responses
and modifications of the blood level of some hormones (Berliner
et al., 1996
). By analogy with the slow
voltage change evoked by odorants at the surface of the olfactory
epithelium, this electrical signal has been considered by the
authors as the receptor potential induced by activation of
vomeronasal receptor neurons. According to this interpretation,
the activation of the vomeronasal pit may trigger autonomic responses
and modifications of the blood level of some hormones (Berliner
et al., 1996![]() ; Monti-Bloch et al.,
1998a
; Monti-Bloch et al.,
1998a![]() ,b
,b![]() ). However, to our knowledge, the
existence of functional vomeronasal receptor neurons that connect to
the brain is doubtful in adult humans (Jordan, 1973
). However, to our knowledge, the
existence of functional vomeronasal receptor neurons that connect to
the brain is doubtful in adult humans (Jordan, 1973![]() ; Johnson et al.,
1985
; Johnson et al.,
1985![]() ; Moran et al., 1991
; Moran et al., 1991![]() ; Johnson, 1998
; Johnson, 1998![]() ; Smith et al., 1998
; Smith et al., 1998![]() ). The immunohistochemistry shown
here demonstrates the absence both of OMP and of glial elements
essential for the wrapping of the unmyelinated vomeronasal axons.
). The immunohistochemistry shown
here demonstrates the absence both of OMP and of glial elements
essential for the wrapping of the unmyelinated vomeronasal axons.
It
has been demonstrated that OMP is a protein that is found in
mature neurons in the olfactory epithelium (Buiakova et al., 1994![]() ; Krishna et al., 1995
; Krishna et al., 1995![]() ; Walters et al., 1996
; Walters et al., 1996![]() ) and in the vomeronasal
organ of other species (Johnson et al., 1993
) and in the vomeronasal
organ of other species (Johnson et al., 1993![]() ; Berghard et al.,
1996
; Berghard et al.,
1996![]() ; Liman and Corey, 1996
; Liman and Corey, 1996![]() ). Therefore if mature vomeronasal
neurons exist in adult humans it should be possible to demonstrate
OMP. However, in the present study no staining was found in the
vomeronasal epithelia using an antibody against OMP. In other
species, new vomeronasal receptor neurons grow out from progenitor
cells (Barber and Raisman, 1978
). Therefore if mature vomeronasal
neurons exist in adult humans it should be possible to demonstrate
OMP. However, in the present study no staining was found in the
vomeronasal epithelia using an antibody against OMP. In other
species, new vomeronasal receptor neurons grow out from progenitor
cells (Barber and Raisman, 1978![]() ; Wang and Halpern, 1988
; Wang and Halpern, 1988![]() ). If this renewal process exists
in adult humans, some new immature receptor neurons may appear
from time to time. That could explain why some intraepithelial
cells, having a typical bipolar shape, can be observed when
histological sections are stained with an antibody against
neuron-specific enolase (Takami et al., 1993
). If this renewal process exists
in adult humans, some new immature receptor neurons may appear
from time to time. That could explain why some intraepithelial
cells, having a typical bipolar shape, can be observed when
histological sections are stained with an antibody against
neuron-specific enolase (Takami et al., 1993![]() ) or remain unstained with
anti-keratin antibody (Figure 5, V). However, these putative
immature neurons are present at a very low density that seems
quite problematic for eliciting any surface potential change
during chemical stimulations.
) or remain unstained with
anti-keratin antibody (Figure 5, V). However, these putative
immature neurons are present at a very low density that seems
quite problematic for eliciting any surface potential change
during chemical stimulations.
The
presence of a few neuron-like cells in the adult vomeronasal epithelium
does not imply that a message is sent to the brain. For doing so,
vomeronasal neurons must be connected to the accessory olfactory
bulb. Ensheathing glial cells expressing S-100 are present around
vomeronasal nerve fibres in other species (Astic et al.,
1998![]() ). In the present study we did not
find vomeronasal nerve bundles using a specific antibody against
S-100 protein whereas olfactory nerve bundles were stained. In
this context, it is difficult to assign a sensory function to the
vomeronasal epithelium of human adults.
). In the present study we did not
find vomeronasal nerve bundles using a specific antibody against
S-100 protein whereas olfactory nerve bundles were stained. In
this context, it is difficult to assign a sensory function to the
vomeronasal epithelium of human adults.
From embryos to adults
The
vomeronasal ducts develop in human embryos (Bossy, 1980![]() ; Kreutzer and Jafek,
1980
; Kreutzer and Jafek,
1980![]() ). According to Boehm and Gasser
(Boehm and Gasser, 1993
). According to Boehm and Gasser
(Boehm and Gasser, 1993![]() ), at 12 and 23 weeks of gestation
the vomeronasal epithelium contains clusters of neuron-specific
enolase-positive cells looking like olfactory receptors; at 36
weeks the organ is lined by a respiratory epithelium and does not
show any receptor-like cells. Ortmann (Ortmann, 1989
), at 12 and 23 weeks of gestation
the vomeronasal epithelium contains clusters of neuron-specific
enolase-positive cells looking like olfactory receptors; at 36
weeks the organ is lined by a respiratory epithelium and does not
show any receptor-like cells. Ortmann (Ortmann, 1989![]() ) found receptor cells in four
out of seven foetal vomeronasal organs (11–18 weeks). Luteinizing
hormone-releasing hormone (LHRH)-immunoreactive cells are detected
in the bilateral vomeronasal organs at 8–12 gestational weeks
(Kjær and Fischer Hansen, 1996a
) found receptor cells in four
out of seven foetal vomeronasal organs (11–18 weeks). Luteinizing
hormone-releasing hormone (LHRH)-immunoreactive cells are detected
in the bilateral vomeronasal organs at 8–12 gestational weeks
(Kjær and Fischer Hansen, 1996a![]() ) and in the nerve
fascicles arising from the organ to the olfactory bulb (Boehm
et al., 1994
) and in the nerve
fascicles arising from the organ to the olfactory bulb (Boehm
et al., 1994![]() ; Kjær and Fischer Hansen,
1996b
; Kjær and Fischer Hansen,
1996b![]() ). As in other mammals,
LHRH-secreting neurons migrate from the olfactory placode to the
brain during the early stages of foetal life, following
vomeronasal and terminal nerve fibres (Schwanzel-Fukuda et al.,
1996
). As in other mammals,
LHRH-secreting neurons migrate from the olfactory placode to the
brain during the early stages of foetal life, following
vomeronasal and terminal nerve fibres (Schwanzel-Fukuda et al.,
1996![]() ). In some foetuses (10–12 weeks)
the vomeronasal organ is clearly dissolving; in 17- to 19-week-old
foetuses the vomeronasal organ may not be found (Kjær and
Fischer Hansen, 1996a
). In some foetuses (10–12 weeks)
the vomeronasal organ is clearly dissolving; in 17- to 19-week-old
foetuses the vomeronasal organ may not be found (Kjær and
Fischer Hansen, 1996a![]() ). The development of the
vomeronasal structures seems to be limited to the embryonic stage,
when they play a role for the migration of LHRH-secreting cells
towards the brain.
). The development of the
vomeronasal structures seems to be limited to the embryonic stage,
when they play a role for the migration of LHRH-secreting cells
towards the brain.
In
all other species, vomeronasal receptor axons make synaptic contact
with secondary neurons in the accessory olfactory bulb. In human
foetuses, the accessory olfactory bulb is present at 8 weeks
(Bossy, 1980![]() ), 18 weeks (Humphrey, 1940
), 18 weeks (Humphrey, 1940![]() ; Meisami and Bathnagar,
1998
; Meisami and Bathnagar,
1998![]() ) and 26 weeks (Humphrey, 1940
) and 26 weeks (Humphrey, 1940![]() ). However, in older
foetuses the accessory olfactory bulb regresses and, indeed, is not
found in the adult human [for a review see (Meisami and Bathnagar,
1998
). However, in older
foetuses the accessory olfactory bulb regresses and, indeed, is not
found in the adult human [for a review see (Meisami and Bathnagar,
1998![]() )].
)].
|
|
Conclusion |
The present study has given anatomical, histological and immunohistochemical
data that all indicate that in adult humans the vomeronasal structure
is a remnant of the vomeronasal organ found in mammals. This
statement is in accordance with findings and opinions of previous
authors as discussed above. In our opinion, a viable function of
receptor neurons has never been convincingly demonstrated. We
consider that the vomeronasal structure does not function as a
sensory organ in adult humans. In conclusion, the vomeronasal structure
might have a function only during human foetal life in
contributing, together with the terminal nerve and other structures,
to the migration of neurosecretory cells containing LHRH to their
proper sites in the brain.
http://chemse.oxfordjournals.org/cgi/content/full/25/4/369
|
Abstract |
The human vomeronasal organ (VNO) has been the subject of some interest
in the scientific literature and of considerable speculation in the
popular science literature. A function for the human VNO has been
both dismissed with ridicule and averred with conviction. This
question of VNO function has been needlessly tied to the separate
question of whether there is any place for pheromone communication
among humans, a topic that is itself bogged down in conflicting
definitions. This review is an attempt to weigh the evidence for
and against human VNO function, to deconvolve that question from
the question of pheromone communication and finally to provide a
working definition of ‘pheromone’. Further experimental work is
required to resolve the conflicting evidence for and against human
VNO function but chemical communication does appear to occur among
humans. However, several examples reported in the literature do
not meet the proposed definition for communication by pheromones:
‘chemical substances released by one member of a species as
communication with another member, to their mutual benefit’.
|
|
Introduction |
The vomeronasal organ (VNO) is the peripheral sensory organ of the
accessory olfactory system. The paired organs are located at the base
of the nasal septum or in the roof of the mouth in most amphibia,
reptiles and mammals. There are numerous examples of vomeronasal
involvement in chemical communication, although pheromone
communication is not the exclusive province of the vomeronasal
system. The increase in serum luteinizing hormone and testosterone
when male mice and hamsters are exposed to chemosensory stimuli
from females appears to be absolutely dependent on vomeronasal
integrity (Coquelin et al., 1984![]() ; Pfeiffer and Johnston,
1994
; Pfeiffer and Johnston,
1994![]() ). Induction of uterine growth and
estrus in female prairie voles normally resulting from exposure to
males is also dependent on an intact VNO (Tubbiola and Wysocki,
1997
). Induction of uterine growth and
estrus in female prairie voles normally resulting from exposure to
males is also dependent on an intact VNO (Tubbiola and Wysocki,
1997![]() ). There are numerous
other behaviors and physiological responses where both vomeronasal
and olfactory inputs contribute (Wysocki and Meredith, 1987
). There are numerous
other behaviors and physiological responses where both vomeronasal
and olfactory inputs contribute (Wysocki and Meredith, 1987![]() ; Johnston, 1998
; Johnston, 1998![]() ) and some where the main
olfactory system seems to be critical (see below). In some
non-mammalian species, for example in snakes, vomeronasal
chemoreception may be used for tracking prey (Halpern, 1987
) and some where the main
olfactory system seems to be critical (see below). In some
non-mammalian species, for example in snakes, vomeronasal
chemoreception may be used for tracking prey (Halpern, 1987![]() ), which is unlikely to
be a pheromone function. Whether the vomeronasal systems in
mammals have any similar non-social communication functions has
not been thoroughly investigated. In humans there has been a
long-standing dispute over whether there is a VNO at all in adults.
Recent endoscopic and microscopic observations suggest that there
is an organ on at least one side in most adults. This
review enquires into its function.
), which is unlikely to
be a pheromone function. Whether the vomeronasal systems in
mammals have any similar non-social communication functions has
not been thoroughly investigated. In humans there has been a
long-standing dispute over whether there is a VNO at all in adults.
Recent endoscopic and microscopic observations suggest that there
is an organ on at least one side in most adults. This
review enquires into its function.
|
|
Description:
anatomical, developmental and genetic evidence |
Structure
The
existence of a VNO in the human embryo similar to the VNOs of
other species is undisputed (Boehm and Gasser, 1993![]() ). It contains bipolar
cells similar to the developing vomeronasal sensory neurons of
other species and also generates luteinizing hormone releasing
hormone (LHRH)-producing cells as in other species (Boehm et al.,
1994
). It contains bipolar
cells similar to the developing vomeronasal sensory neurons of
other species and also generates luteinizing hormone releasing
hormone (LHRH)-producing cells as in other species (Boehm et al.,
1994![]() ; Kajer and Fischer Hansen, 1996
; Kajer and Fischer Hansen, 1996![]() ). These authors showed
the structure becoming more simplified later in development. The
latter were unable to find any VNO structure at later stages (19
weeks), although others have shown a simplified but clear VNO
continuing to increase in size up to at least 30 weeks (Bohm and
Gasser, 1993
). These authors showed
the structure becoming more simplified later in development. The
latter were unable to find any VNO structure at later stages (19
weeks), although others have shown a simplified but clear VNO
continuing to increase in size up to at least 30 weeks (Bohm and
Gasser, 1993![]() ; Smith et al., 1997
; Smith et al., 1997![]() ). Numerous reports of
a structure identified as the VNO in the nasal septum in adult
humans agree that it is a blind ending diverticulum in the septal
mucosa opening via a depression (the VNO pit) into the nasal
cavity
). Numerous reports of
a structure identified as the VNO in the nasal septum in adult
humans agree that it is a blind ending diverticulum in the septal
mucosa opening via a depression (the VNO pit) into the nasal
cavity ![]() 2 cm in from the nostril. The
location of this structure is consistent with the location of the
VNO in embryos (Trotier et al., 2000
2 cm in from the nostril. The
location of this structure is consistent with the location of the
VNO in embryos (Trotier et al., 2000![]() ) and it has a similar simplified
form, with no large blood vessels, cavernous sinuses or supporting
cartilage. The structure is reported at least unilaterally in 90%
or more of subjects in some reports or in 50% or fewer in other
reports. Trotier et al. recently demonstrated that the
endoscopic appearance of the VNO pit can vary, unequivocal on one
inspection and invisible on a later inspection, or vice versa
(Trotier et al., 2000
) and it has a similar simplified
form, with no large blood vessels, cavernous sinuses or supporting
cartilage. The structure is reported at least unilaterally in 90%
or more of subjects in some reports or in 50% or fewer in other
reports. Trotier et al. recently demonstrated that the
endoscopic appearance of the VNO pit can vary, unequivocal on one
inspection and invisible on a later inspection, or vice versa
(Trotier et al., 2000![]() ). The real percentage of
individuals with at least one VNO pit may thus be underestimated
in many studies. Trotier et al. estimate
). The real percentage of
individuals with at least one VNO pit may thus be underestimated
in many studies. Trotier et al. estimate ![]() 92% with some evidence of at least
one VNO pit in subjects with no septal surgery examined multiple
times, but a substantially lower number after septal surgery
(Trotier et al., 2000
92% with some evidence of at least
one VNO pit in subjects with no septal surgery examined multiple
times, but a substantially lower number after septal surgery
(Trotier et al., 2000![]() ). Standard septal surgery may
remove the VNOs and there are anecdotal reports of adverse effects
of vomeronasal removal, but no systematic study. In histological studies
in cadavers or in septal tissue removed during nasal surgery,
several authors (Moran et al., 1991
). Standard septal surgery may
remove the VNOs and there are anecdotal reports of adverse effects
of vomeronasal removal, but no systematic study. In histological studies
in cadavers or in septal tissue removed during nasal surgery,
several authors (Moran et al., 1991![]() ; Johnson et al., 1994
; Johnson et al., 1994![]() ; Trotier et al., 2000
; Trotier et al., 2000![]() ) describe a blind ending tube
lined on all sides by a pseudo-stratified epithelium and with
associated submucosal glands. It seems highly likely that this
structure is the adult human remnant of the vomeronasal organ. Use
of the word organ in this context does not presuppose function.
) describe a blind ending tube
lined on all sides by a pseudo-stratified epithelium and with
associated submucosal glands. It seems highly likely that this
structure is the adult human remnant of the vomeronasal organ. Use
of the word organ in this context does not presuppose function.
Best case:
The vast majority of human adults have a VNO.
Worst case:
There is a diverticulum of the nasal epithelium which happens to
be remarkably consistently located at the expected position of the
VNO.
Opinion:
There is an adult human VNO.
Microanatomy
The
epithelium lining the human VNO is unlike that of VNOs in other
species and unlike that of olfactory or respiratory epithelium in
humans (Moran et al., 1991![]() ; Stensaas et al., 1991
; Stensaas et al., 1991![]() ). There are many
elongated cells presenting a microvillar surface to the lumen of
the organ but most are not similar to microvillar vomeronasal
sensory organs (VSNs) of other species. They have not been shown
to have axons leaving the epithelium nor to make synaptic contact
with axons in the epithelium, so if they are chemosensitive they
have no obvious way of communication with the brain.
). There are many
elongated cells presenting a microvillar surface to the lumen of
the organ but most are not similar to microvillar vomeronasal
sensory organs (VSNs) of other species. They have not been shown
to have axons leaving the epithelium nor to make synaptic contact
with axons in the epithelium, so if they are chemosensitive they
have no obvious way of communication with the brain.
Two
studies of the adult human vomeronasal epithelium have reported the
presence of bipolar cells resembling the VSNs found in other species
and in early human embryos. These cells contain marker substances
characteristic of neural cells. Takami et al. and Trotier
et al. found neuron-specific enolase (NSE) staining in these
cells (Takami et al., 1993![]() ; Trotier et al., 2000
; Trotier et al., 2000![]() ). It is clear from
both reports that the number of such cells is small:
). It is clear from
both reports that the number of such cells is small: ![]() 4 per 100 µm epithelial surface
(Takami et al., 1993
4 per 100 µm epithelial surface
(Takami et al., 1993![]() ) or less (Trotier et al.,
2000
) or less (Trotier et al.,
2000![]() ). Neither found the olfactory
marker protein (OMP) staining characteristic of VSNs of all other
species studied. No one has been able to show that these VSN-like cells
in the adult human VNO taper down to form axons at their basal
ends. Axons are observed in the epithelium (Stensaas et al.,
1991
). Neither found the olfactory
marker protein (OMP) staining characteristic of VSNs of all other
species studied. No one has been able to show that these VSN-like cells
in the adult human VNO taper down to form axons at their basal
ends. Axons are observed in the epithelium (Stensaas et al.,
1991![]() ), but not in continuity or in
synaptic contact with epithelial cells. Axon bundles are reported
in the submucosa (Stensaas et al., 1991
), but not in continuity or in
synaptic contact with epithelial cells. Axon bundles are reported
in the submucosa (Stensaas et al., 1991![]() ), but do not appear to arise from
axon bundles penetrating the lamina propria in the same way as in
vomeronasal epithelia of other species. Moreover, the fact that a
few human VNO cells show a morphological resemblance to VSNs does
not preclude chemosensitivity in other cell types. The human
vomeronasal epithelium differs in appearance from both the sensory
and non-sensory epithelia in the VNOs of other species and from
nasal ‘respiratory’ epithelium (Moran et al., 1991
), but do not appear to arise from
axon bundles penetrating the lamina propria in the same way as in
vomeronasal epithelia of other species. Moreover, the fact that a
few human VNO cells show a morphological resemblance to VSNs does
not preclude chemosensitivity in other cell types. The human
vomeronasal epithelium differs in appearance from both the sensory
and non-sensory epithelia in the VNOs of other species and from
nasal ‘respiratory’ epithelium (Moran et al., 1991![]() ; Stensaas et al., 1991
; Stensaas et al., 1991![]() ). The function of the cells is
not immediately obvious from their morphology. However, the absence
of OMP and any reports of putative vomeronasal receptor genes (see
below) means that any such cells are quite different from known
VSNs in other species.
). The function of the cells is
not immediately obvious from their morphology. However, the absence
of OMP and any reports of putative vomeronasal receptor genes (see
below) means that any such cells are quite different from known
VSNs in other species.
Best case:
The human VNO contains cells resembling sensory neurons even
though these do not show many of the other characteristics of VSNs
in other species and no axons have been identified. (Speculative)
Other cells might conceivably be chemosensitive, even though there
is no evidence for this in the morphology or characteristic
staining patterns of any other cell type.
Worst case:
The human VNO is devoid of neurons showing the characteristics of
VSNs in other species and devoid of other cells with clear axons
leaving the vomeronasal epithelium.
Opinion:
There are no obvious sensory neurons.
Putative receptor gene expression
Recent
evidence (Dulac and Axel, 1995![]() ; Herrada and Dulac, 1997
; Herrada and Dulac, 1997![]() ; Matsunami and Buck,
1997
; Matsunami and Buck,
1997![]() ; Ryba and Tirrindelli, 1997
; Ryba and Tirrindelli, 1997![]() ) suggests that
mammalian species with functional VNOs express two families of genes
(V1R and V2R) that appear to code for ‘seven transmembrane domain’
membrane proteins thought to be the chemoreceptor molecules
themselves. These genes are expressed in VSNs and are similar in
apparent transmembrane organization to olfactory receptor genes
(Buck and Axel, 1991
) suggests that
mammalian species with functional VNOs express two families of genes
(V1R and V2R) that appear to code for ‘seven transmembrane domain’
membrane proteins thought to be the chemoreceptor molecules
themselves. These genes are expressed in VSNs and are similar in
apparent transmembrane organization to olfactory receptor genes
(Buck and Axel, 1991![]() ), but differ in much
of their DNA sequence. These genes were labeled ‘putative pheromone
receptor genes’, although at the time of their discovery the
evidence that they might code for pheromone receptor molecules was
tenuous. Their expression in the vomeronasal epithelium is no
guarantee: some pheromones are clearly detected by the main
olfactory system (see below) and possible non-pheromone functions
of the vomeronasal system (as in snakes) have not been
investigated. Recently, Leinders-Zufall et al. showed physiological
responses in mouse VSNs to substances reported to be pheromones in
that species (Leinders-Zufall et al., 2000
), but differ in much
of their DNA sequence. These genes were labeled ‘putative pheromone
receptor genes’, although at the time of their discovery the
evidence that they might code for pheromone receptor molecules was
tenuous. Their expression in the vomeronasal epithelium is no
guarantee: some pheromones are clearly detected by the main
olfactory system (see below) and possible non-pheromone functions
of the vomeronasal system (as in snakes) have not been
investigated. Recently, Leinders-Zufall et al. showed physiological
responses in mouse VSNs to substances reported to be pheromones in
that species (Leinders-Zufall et al., 2000![]() ). The responsive neurons
were in the apical zone of the vomeronasal epithelium where most
neurons appear to express members of the V1R class of putative
vomeronasal receptor genes. This is the best evidence yet that
some members of this gene family might be pheromone receptors. The
neurons were extremely sensitive and highly selective, characteristics
we have come to expect for pheromone receptor neurons in insects.
Electrical responses to urine of VSNs (Holy et al., 2000
). The responsive neurons
were in the apical zone of the vomeronasal epithelium where most
neurons appear to express members of the V1R class of putative
vomeronasal receptor genes. This is the best evidence yet that
some members of this gene family might be pheromone receptors. The
neurons were extremely sensitive and highly selective, characteristics
we have come to expect for pheromone receptor neurons in insects.
Electrical responses to urine of VSNs (Holy et al., 2000![]() ) provide some supporting
evidence, but this report does not address the questions of which
sensory neuron types respond nor which components of urine are
stimulatory.
) provide some supporting
evidence, but this report does not address the questions of which
sensory neuron types respond nor which components of urine are
stimulatory.
Genes
similar to the vomeronasal receptor genes are also present in the
human genome. Those found in initial searches through the genome
are clearly pseudogenes (Dulac and Axel, 1995![]() ; Herrada and Dulac,
1997
; Herrada and Dulac,
1997![]() ), i.e. they have defects in their
sequence that would prevent transcription and translation of the
expected transmembrane protein. Not all human sequences related to
vomeronasal receptor genes have been investigated in detail, so
this negative evidence should be viewed with some caution. Some
70% of known olfactory receptor genes have also been reported to
be pseudogenes in humans (Rouquier et al., 1998
), i.e. they have defects in their
sequence that would prevent transcription and translation of the
expected transmembrane protein. Not all human sequences related to
vomeronasal receptor genes have been investigated in detail, so
this negative evidence should be viewed with some caution. Some
70% of known olfactory receptor genes have also been reported to
be pseudogenes in humans (Rouquier et al., 1998![]() ), although a lower percentage
is reported in more recent reports (Lane et al., 2000
), although a lower percentage
is reported in more recent reports (Lane et al., 2000![]() ), and humans still
have a useful and important sense of smell. In a recent paper
Rodriguez et al. reported the discovery of a previously
undetected human gene closely related to the V1R family in rodents
(Rodriguez et al., 2000
), and humans still
have a useful and important sense of smell. In a recent paper
Rodriguez et al. reported the discovery of a previously
undetected human gene closely related to the V1R family in rodents
(Rodriguez et al., 2000![]() ). Whether it is expressed in
human vomeronasal epithelium was not reported, but it is expressed
in the main olfactory epithelium. From the argument above it
should be clear that the location of its expression does not
preclude a pheromone detector function. However, its relationship
to animal vomeronasal genes is not good evidence for such a
function and throws no light on the question of human vomeronasal
function. If expression of one of these genes is detected in human
vomeronasal epithelium it will be interesting to know whether it
is expressed in cells resembling axonless VSNs or in one of the
other types of cell. In either case, a renewed effort to determine
whether there is any connection with the brain would be critical
to any hypothesis about function.
). Whether it is expressed in
human vomeronasal epithelium was not reported, but it is expressed
in the main olfactory epithelium. From the argument above it
should be clear that the location of its expression does not
preclude a pheromone detector function. However, its relationship
to animal vomeronasal genes is not good evidence for such a
function and throws no light on the question of human vomeronasal
function. If expression of one of these genes is detected in human
vomeronasal epithelium it will be interesting to know whether it
is expressed in cells resembling axonless VSNs or in one of the
other types of cell. In either case, a renewed effort to determine
whether there is any connection with the brain would be critical
to any hypothesis about function.
Best case:
The expression in human olfactory epithelium of a gene related to
those expressed in VSNs in animals raises the possibility that
other new genes may be discovered which are expressed in human
vomeronasal cells. There is also a possibility that neurons
located in the main olfactory epithelium in humans may have taken
over functions assigned to VSNs in rodents.
Worst case:
The receptor coded for by the expressed gene of the vomeronasal
gene family could bind a regular odor in humans or a substance
that is a pheromone in other species but not in humans. There is
no evidence that the protein product of the gene, if any, is
expressed on the apical surface membrane in a location accessible
to external stimuli.
Opinion:
The newly discovered gene tells us nothing about human vomeronasal
function. Calling these genes putative pheromone receptor genes is
speculative.
Connectivity
In
rodents and other species with well-developed VNOs the axons of
VSNs pass in bundles to an accessory olfactory bulb (AOB) of
characteristic structure. There is no trace of this structure in adult
humans (Humphrey 1940![]() ; Meisami and Bhatnagar, 1998
; Meisami and Bhatnagar, 1998![]() ), although it is
present in the fetus (Chuah and Zeng, 1987
), although it is
present in the fetus (Chuah and Zeng, 1987![]() ), and it is generally
reported missing in rhesus monkeys and other old world primates (Wysocki,
1979
), and it is generally
reported missing in rhesus monkeys and other old world primates (Wysocki,
1979![]() ; Stephan et al., 1982
; Stephan et al., 1982![]() ). It is possible for
an accessory bulb to go undetected or be misidentified. The AOB of
the mustelid carnivores (ferret and polecat) has been described as
absent (Jawlowski, 1956
). It is possible for
an accessory bulb to go undetected or be misidentified. The AOB of
the mustelid carnivores (ferret and polecat) has been described as
absent (Jawlowski, 1956![]() ) or large (Dennis and
Kerr, 1969
) or large (Dennis and
Kerr, 1969![]() ), but recent work in ferrets
shows a small AOB, somewhat differently placed than in rodents
(Kelliher et al., 1997
), but recent work in ferrets
shows a small AOB, somewhat differently placed than in rodents
(Kelliher et al., 1997![]() ) (K.R. Kelliher et al.,
unpublished results). The stretching out that occurs during
development in the olfactory bulbs and peduncles of higher
primates might distort any small AOB that did exist, although a
normal AOB is present in new world primates and prosimians (Evans
and Schilling, 1995
) (K.R. Kelliher et al.,
unpublished results). The stretching out that occurs during
development in the olfactory bulbs and peduncles of higher
primates might distort any small AOB that did exist, although a
normal AOB is present in new world primates and prosimians (Evans
and Schilling, 1995![]() ). An explicit search for
such a structure in humans has not found it (Meisami and Bhatnagar,
1998
). An explicit search for
such a structure in humans has not found it (Meisami and Bhatnagar,
1998![]() ).
).
The
best candidates for VSNs, those expressing NSE, have not been
traced in connectivity with axons and neither have any other cells
of the human VNO. One characteristic marker of axon bundles, the
S100 protein, expressed in glial cells surrounding axons, was not
observed in or near the human VNO epithelium by Trotier et al.
(Trotier et al., 2000![]() ). It is not clear whether a
few isolated axons might go unnoticed with this method. There are
axons within the human VNO and Schwann cell-wrapped bundles of
axons underlying it (Stensaas et al., 1991
). It is not clear whether a
few isolated axons might go unnoticed with this method. There are
axons within the human VNO and Schwann cell-wrapped bundles of
axons underlying it (Stensaas et al., 1991![]() ; Jahnke and Merker, 2000
; Jahnke and Merker, 2000![]() ), so it is somewhat surprising
that Trotier et al. did not find S100 expression close to
the VNO (Trotier et al., 2000
), so it is somewhat surprising
that Trotier et al. did not find S100 expression close to
the VNO (Trotier et al., 2000![]() ). Many of the axons in
this region belong to other well-recognized systems of the nasal
cavity, the trigeminal, autonomic and nervus terminalis systems.
The trigeminal system includes somatosensory and general
chemosensory nerves, most or all of which may be nociceptive
(Thurauf et al., 1993
). Many of the axons in
this region belong to other well-recognized systems of the nasal
cavity, the trigeminal, autonomic and nervus terminalis systems.
The trigeminal system includes somatosensory and general
chemosensory nerves, most or all of which may be nociceptive
(Thurauf et al., 1993![]() ). Nerve bundles of the autonomic
nervous system control blood vessels and glands. The nervus terminalis
(Brookover, 1914
). Nerve bundles of the autonomic
nervous system control blood vessels and glands. The nervus terminalis
(Brookover, 1914![]() ; Pearson, 1941
; Pearson, 1941![]() ) characteristically connects
the VNO and the brain in the fetus and clearly persists in human
adults (Brookover, 1914
) characteristically connects
the VNO and the brain in the fetus and clearly persists in human
adults (Brookover, 1914![]() ). The nerve appears to be the
pathway for migration of LHRH (GnRH) neurons into the brain from
the olfactory/vomeronasal epithelium early in development, in
humans as in other species (Schwanzel-Fukuda and Pfaff, 1989
). The nerve appears to be the
pathway for migration of LHRH (GnRH) neurons into the brain from
the olfactory/vomeronasal epithelium early in development, in
humans as in other species (Schwanzel-Fukuda and Pfaff, 1989![]() ; Ronkliev and Resko,
1990
; Ronkliev and Resko,
1990![]() ; Boehm et al., 1994
; Boehm et al., 1994![]() ). Its persistence in
adults suggests some continuing function, as does its internal structure
in species where it is most prominent (White and Meredith, 1995
). Its persistence in
adults suggests some continuing function, as does its internal structure
in species where it is most prominent (White and Meredith, 1995![]() ). There is no evidence that this
nerve is chemosensory or that the human terminalis nerve carries
the axons of VSNs (although the two do run together in most
mammals), but it may innervate the vomeronasal epithelium (Witkin
and Silverman, 1983
). There is no evidence that this
nerve is chemosensory or that the human terminalis nerve carries
the axons of VSNs (although the two do run together in most
mammals), but it may innervate the vomeronasal epithelium (Witkin
and Silverman, 1983![]() ; Wirsig and Leonard, 1986
; Wirsig and Leonard, 1986![]() ).
).
Best case:
(Speculative) If there are VSNs in the human VNO their axons could
make their way to the brain singly or in small bundles expressing
undetectable levels of S100 protein. The equivalent of the AOB
might be present if distorted during normal development so as to
be unrecognizable as a separate structure.
Worst case:
There is no evidence for nerve–axon connections between any
possibly sensory cells in the VNO and the brain and no evidence
for an AOB.
Opinion:
This is one of the big obstacles to the hypothesis of human VNO
function.
|
|
Positive evidence? |
None of the speculations about vomeronasal chemosensory neurons would
be worth much consideration if there were not some positive evidence
for a non-olfactory, non-trigeminal chemosensory function located
in the region of the human VNO. This evidence comes almost
exclusively from the work of Monti-Bloch and colleagues. They
report an electrophysiological response to application of small
amounts of steroid chemicals confined to the VNO region. Because
these studies are supported in part by corporations with a
commercial interest in exploiting the findings, the results are
widely discounted by the academic community. However, they should be
evaluated on their merits. There is no serious error in
methodology that is obvious from the published papers, so they
have to be taken seriously. There is also evidence in these reports
for a systemic physiological response to this stimulation and although
anecdotal evidence suggests no conscious response in awake human
subjects, there is evidence for an alteration of mood. The
physiological evidence is critically evaluated in the next
section; the behavioral evidence is considered later.
Physiology
If
physiological responses are to be attributed to chemical stimulation
of the VNO there must be confidence that the stimuli were indeed
confined to the VNO. Since there is no independent criterion for
chemicals that stimulate VSNs, the nature of the stimulus is not a
guarantor of VNO stimulation. The only published attempts to
record responses to stimuli applied selectively to the human VNO
come from Monti-Bloch and colleagues. Three types of responses
have been reported, local electrical responses, responses from
isolated cells and systemic responses. The first type of response
is a local negative electrical potential, termed the
‘electrovomeronasogram’ (EVG) (Monti-Bloch and Grosser, 1991![]() ), recorded from the VNO pit
region in awake human subjects. It is named by analogy with the
electro-olfactogram (EOG) which can be recorded from the surface
of the olfactory epithelium in response to odor stimulation
(Ottoson, 1956
), recorded from the VNO pit
region in awake human subjects. It is named by analogy with the
electro-olfactogram (EOG) which can be recorded from the surface
of the olfactory epithelium in response to odor stimulation
(Ottoson, 1956![]() ; Getchell and
Getchell, 1987
; Getchell and
Getchell, 1987![]() ). Stimuli tested for an EVG response
included steroids claimed to be similar to chemicals extracted
from human skin, including androstadienones and estratetraenyl
compounds, as well as conventional odors. The steroids elicited
clear EVG responses; the conventional odors did not. In both cases
stimuli were delivered directly to the VNO pit through the inner
of a pair of concentric tubes, the outer of which was used to
scavenge excess stimulus to prevent spread to other areas of the
nose. In control experiments the same stimulator was directed at
sites successively further from the pit resulting in a decline of
EVG amplitude to undetectable levels a short distance away (Monti-Bloch
and Grosser, 1991
). Stimuli tested for an EVG response
included steroids claimed to be similar to chemicals extracted
from human skin, including androstadienones and estratetraenyl
compounds, as well as conventional odors. The steroids elicited
clear EVG responses; the conventional odors did not. In both cases
stimuli were delivered directly to the VNO pit through the inner
of a pair of concentric tubes, the outer of which was used to
scavenge excess stimulus to prevent spread to other areas of the
nose. In control experiments the same stimulator was directed at
sites successively further from the pit resulting in a decline of
EVG amplitude to undetectable levels a short distance away (Monti-Bloch
and Grosser, 1991![]() ). These results are interpreted
as showing that chemosensitivity is restricted to the pit and that
the stimulus is restricted to a small region near the tip of the
stimulator. The same stimulator directed at the olfactory epithelium
allowed conventional odors to elicit an EOG. Several steroids effective
in generating an EVG from the VNO failed to produce an EOG
response from the olfactory epithelium. The subjects generally
reported no sensation from direct chemical stimulation of the VNO,
even when an EVG was recorded, but they reported an odor sensation
when an EOG was elicited. The authors concluded that the EVG was
the summed receptor potential of many VSNs responding to the
stimulus. There are problems with this interpretation (see below),
but there does appear to be some process located in or near the
VNO pit that produces, selectively, an electrical response to
small quantities of some chemicals. ‘Vomeropherin’ has been
suggested as a name for chemicals that elicit this response and as
a general term for substances that stimulate the VNO in any
species (Berliner et al., 1996
). These results are interpreted
as showing that chemosensitivity is restricted to the pit and that
the stimulus is restricted to a small region near the tip of the
stimulator. The same stimulator directed at the olfactory epithelium
allowed conventional odors to elicit an EOG. Several steroids effective
in generating an EVG from the VNO failed to produce an EOG
response from the olfactory epithelium. The subjects generally
reported no sensation from direct chemical stimulation of the VNO,
even when an EVG was recorded, but they reported an odor sensation
when an EOG was elicited. The authors concluded that the EVG was
the summed receptor potential of many VSNs responding to the
stimulus. There are problems with this interpretation (see below),
but there does appear to be some process located in or near the
VNO pit that produces, selectively, an electrical response to
small quantities of some chemicals. ‘Vomeropherin’ has been
suggested as a name for chemicals that elicit this response and as
a general term for substances that stimulate the VNO in any
species (Berliner et al., 1996![]() ). So far, there are no
other distinguishing features for such chemicals.
). So far, there are no
other distinguishing features for such chemicals.
As
a second type of response, Monti Bloch et al. have also reported preliminary
evidence that bipolar cells aspirated from the human VNO pit show
an electrical responses to some ‘vomeropherins’ (Monti-Bloch et
al., 1998b![]() ). These are the EVG-eliciting
steroids related to skin chemicals this group has proposed to be
human pheromones. These experiments have not been published in a
fully refereed report. In view of the extreme sparseness of
NSE-expressing human vomeronasal bipolar cells, it seems unlikely
that these are the cells involved. If this initial report is
confirmed it may throw light on other cells contributing to EVG
responses. However, as discussed above, any local VNO response
must be communicated to the brain before a sensory communication
pathway is established.
). These are the EVG-eliciting
steroids related to skin chemicals this group has proposed to be
human pheromones. These experiments have not been published in a
fully refereed report. In view of the extreme sparseness of
NSE-expressing human vomeronasal bipolar cells, it seems unlikely
that these are the cells involved. If this initial report is
confirmed it may throw light on other cells contributing to EVG
responses. However, as discussed above, any local VNO response
must be communicated to the brain before a sensory communication
pathway is established.
Although
no anatomical connection has been demonstrated, Monti-Bloch et
al. deduce a physiological connection with the brain because stimulus
delivery to the VNO pit elicited several systemic responses (Monti-Bloch
and Grosser, 1991![]() , 1998a
, 1998a![]() ,b
,b![]() ). These include changes in
blood pressure and heart rate, small but significant changes in
hormonal levels (Monti-Bloch et al., 1998a
). These include changes in
blood pressure and heart rate, small but significant changes in
hormonal levels (Monti-Bloch et al., 1998a![]() ) and some changes in
mood (Grosser et al., 2000
) and some changes in
mood (Grosser et al., 2000![]() ). It is important to note that
these systemic responses were obtained with the same stimulator used
for EVG recordings, which confines the stimulus to the VNO pit.
Other studies (Berliner et al., 1996
). It is important to note that
these systemic responses were obtained with the same stimulator used
for EVG recordings, which confines the stimulus to the VNO pit.
Other studies (Berliner et al., 1996![]() ) used a different type
of stimulator which was not described in detail and for which
there were no control experiments to determine stimulus spread.
Thus, it is not clear in these experiments that stimuli were
confined to the VNO region. Furthermore, repeated stimulus delivery
over a prolonged period would make low level stimulation of other
nasal sensory systems or systemic uptake of stimulus chemicals
more likely. The hormonal changes elicited by steroid chemicals in
these studies are not evidence for a physiological connection
between the VNO region and the brain and provide no evidence for
VNO function.
) used a different type
of stimulator which was not described in detail and for which
there were no control experiments to determine stimulus spread.
Thus, it is not clear in these experiments that stimuli were
confined to the VNO region. Furthermore, repeated stimulus delivery
over a prolonged period would make low level stimulation of other
nasal sensory systems or systemic uptake of stimulus chemicals
more likely. The hormonal changes elicited by steroid chemicals in
these studies are not evidence for a physiological connection
between the VNO region and the brain and provide no evidence for
VNO function.
Physiological mechanisms
Sources of the EVG
The slow negative potential recorded from the VNO pit is claimed to
be the summed potentials generated by many sensory neurons responding
to chemical stimulation. For the EOG, a similar negative potential
recorded from the olfactory epithelium, this is a reasonable explanation.
There are hundreds to thousands of olfactory sensory neurons close
to the electrode, each contributing a minute amount of current. If
the current generators in the human vomeronasal system are the
NSE-positive bipolar cells (their lack of demonstrable axons does
not disqualify them as local current generators) it is difficult
to explain the size of the recorded EVG.
Comparison with the EOG
In olfactory sensory neurons transduction channels open in response to
odors producing an inward flow of positive charge into the apical
ends of the cells. There is an equal flow of charge out of these
cells in the depths of the epithelium. The electrical circuit is
completed by current flowing extracellularly from the depths to
the surface. The voltage drop along this current path through the
extracellular resistance produces a potential difference,
recordable extracellularly, between the surface (negative) and the
depths (positive). Each responding cell produces a minute current
and therefore a minute potential difference, but many cells all
oriented in the same direction and activated together sum their
currents and generate a correspondingly higher potential
difference between the depths and surface. A conventional EOG
surface electrode records part of this potential difference due to
the small current flowing on a long pathway through the conductive
tissues of the head and past the reference electrode of the
recording circuit. However, most of the current passes directly
through the thickness of the epithelium, through extracellular space
and inactive cells. In the fluid-filled VNO current can easily
pass from a region of active cells to an inactive region. Where
there are very few active cells, especially if they are widely
spaced, there are many transepithelial pathways for the current.
Resistance is low and little potential is developed. In the case
of the human VNO as few as one putative sensory neuron per section
has been reported (Trotier et al., 2000![]() ), although they
apparently did not examine every section. The precise location of
the recording electrode in EVG recording experiments is not well
described, but its effective recording volume is likely to be
biased towards the regions close to the opening (VNO pit). Unless
there were a previously unobserved dense accumulation of the bipolar
cells close to the opening of the organ, the probability of
recording a detectable ‘EVG’ from these cells is very small.
), although they
apparently did not examine every section. The precise location of
the recording electrode in EVG recording experiments is not well
described, but its effective recording volume is likely to be
biased towards the regions close to the opening (VNO pit). Unless
there were a previously unobserved dense accumulation of the bipolar
cells close to the opening of the organ, the probability of
recording a detectable ‘EVG’ from these cells is very small.
Potential artifacts
Alternative explanations for a chemically selective EVG electrical response
include physicochemical artifacts, non-neural biological potentials,
such as secretory or vasomotor responses, and, finally, other
nerve cells or nerve fibers.
Physicochemical artifacts. These can easily be generated in a
system where a bare metal electrode is used to record mucosal surface
potentials. A steady DC junction potential due to polarization develops
at a bare metal electrode in contact with the mucus surface of the
epithelium. Any relative movement, for example by pressure
transients during stimulation with a chemical vapor, will change
the resistance between electrode and mucus, causing a greater or
lesser proportion of the junction potential to be seen by the
recording system. This change would appear as a stimulus-dependent
electrical signal. However, the reported EVG recordings used a
‘non-polarizable’ silver/silver chloride electrode (Monti-Bloch
and Grosser, 1991![]() ; Monti-Bloch et al.,
1998b
; Monti-Bloch et al.,
1998b![]() ), which should generate almost no
junction potential. Artifacts resulting from changes in electrode–
mucus coupling could be produced if DC potentials were to arise
elsewhere in the recording circuit. However, these kinds of
mechanical artifact would not generally depend on the chemical
species of the stimulus, whereas the amplitude and time course of
the EVG recordings are dependent on the chemical used as stimulus
(Monti-Bloch and Grosser, 1991
), which should generate almost no
junction potential. Artifacts resulting from changes in electrode–
mucus coupling could be produced if DC potentials were to arise
elsewhere in the recording circuit. However, these kinds of
mechanical artifact would not generally depend on the chemical
species of the stimulus, whereas the amplitude and time course of
the EVG recordings are dependent on the chemical used as stimulus
(Monti-Bloch and Grosser, 1991![]() ). Different potentials could be
recorded for different stimuli if the coupling between electrode
and mucosa were to change between stimuli, for example when the
experimenter adjusted the electrode position or if there were
drying of the mucosa with the passage of time. However, it is
difficult to imagine that these kinds of changes could produce
consistent differences between chemicals by chance, especially if
stimuli were repeated in random order, as they should be for such
an experiment. The published reports do not give enough detail
to judge whether this was done. Chemical species-dependent electrical
artifacts can also occur in two other circumstances: if the stimulus
chemicals adsorb on the metal electrodes creating transient surface
potentials or if the conductive properties of some stimuli change
the electrical resistance of the surrounding tissue. In EOG recordings
a non-metallic agar/saline bridge can be used to avoid the former
problem, but its larger size may have precluded its use for EVG
recordings. In any case, the very small amounts of the chemicals
used in the published EVG experiments would not be expected to
have large effects of these kinds. Thus, in general,
physicochemical artifacts seem unlikely as an explanation for the
published EVG recordings.
). Different potentials could be
recorded for different stimuli if the coupling between electrode
and mucosa were to change between stimuli, for example when the
experimenter adjusted the electrode position or if there were
drying of the mucosa with the passage of time. However, it is
difficult to imagine that these kinds of changes could produce
consistent differences between chemicals by chance, especially if
stimuli were repeated in random order, as they should be for such
an experiment. The published reports do not give enough detail
to judge whether this was done. Chemical species-dependent electrical
artifacts can also occur in two other circumstances: if the stimulus
chemicals adsorb on the metal electrodes creating transient surface
potentials or if the conductive properties of some stimuli change
the electrical resistance of the surrounding tissue. In EOG recordings
a non-metallic agar/saline bridge can be used to avoid the former
problem, but its larger size may have precluded its use for EVG
recordings. In any case, the very small amounts of the chemicals
used in the published EVG experiments would not be expected to
have large effects of these kinds. Thus, in general,
physicochemical artifacts seem unlikely as an explanation for the
published EVG recordings.
Biological non-neural potentials. These have several possible sources.
Secretory potentials are generated when gland cells secrete their
contents. This may occur in response to local irritation, to a
neural response, that then activates the gland, or, conceivably,
through receptor molecules expressed on the surface of the gland
cells themselves. There are many glands around the human VNO and
many of those empty into the VNO lumen (Trotier et al.,
2000![]() ). Secretory potentials can
contribute to the EOG recorded from the olfactory mucosa (Okano
and Takagi, 1974
). Secretory potentials can
contribute to the EOG recorded from the olfactory mucosa (Okano
and Takagi, 1974![]() ) and may contribute to the EVG.
Blood vessel dilation may also generate a potential from smooth
muscle action or may modulate a pre-existing potential due to
changes in tissue resistance. Some chemicals entering the nose
elicit an immune response from mast cells and other cells in the
mucosa (Suzuki et al., 1999
) and may contribute to the EVG.
Blood vessel dilation may also generate a potential from smooth
muscle action or may modulate a pre-existing potential due to
changes in tissue resistance. Some chemicals entering the nose
elicit an immune response from mast cells and other cells in the
mucosa (Suzuki et al., 1999![]() ). Other substances may
trigger metabolic breakdown processes (Gu et al., 1999
). Other substances may
trigger metabolic breakdown processes (Gu et al., 1999![]() ). Either of these processes could
elicit mucus secretion or dilation of local blood vessels, due to
the release of cytokines (short-range extracellular messenger molecules)
from the activated cells. Stimulus chemicals that activate nociceptive
nerve endings also set off a series of local reactions due to the
release of substance P and other cytokines from the nerve endings
(Suzuki et al., 1999
). Either of these processes could
elicit mucus secretion or dilation of local blood vessels, due to
the release of cytokines (short-range extracellular messenger molecules)
from the activated cells. Stimulus chemicals that activate nociceptive
nerve endings also set off a series of local reactions due to the
release of substance P and other cytokines from the nerve endings
(Suzuki et al., 1999![]() ). The effects include secretion
and blood vessel dilation. Nasal mucosa tends to be rich in all
these mechanisms.
). The effects include secretion
and blood vessel dilation. Nasal mucosa tends to be rich in all
these mechanisms.
The
EVG is reported (again without experimental details) not to be
eliminated by topical lidocaine, a local anesthetic, or atropine,
an autonomic cholinergic antagonist (Monti-Bloch et al.,
1998b![]() ). None of the processes described
above necessarily involves nerve action potentials, so would not
be eliminated by blocking nerve transmission with local
anesthetics. Atropine would be expected to block some reflex
secretory responses and some vasodilation but many autonomic
functions, including vasodilation in the VNO (hamster) (Meredith
and O’Connell, 1979
). None of the processes described
above necessarily involves nerve action potentials, so would not
be eliminated by blocking nerve transmission with local
anesthetics. Atropine would be expected to block some reflex
secretory responses and some vasodilation but many autonomic
functions, including vasodilation in the VNO (hamster) (Meredith
and O’Connell, 1979![]() ), are not sensitive to
atropine. Any potentials generated by any of these mechanisms
would have to be fairly rapid to be responsible for the observed
EVGs. This (and the EVG insensitivity to local anesthetics) would
probably rule out a reflex secretion or vasomotor response that
depended on transmission to the CNS and back. Reflex blood flow
changes in response to nasal irritants are clearly too slow (see
below). Reflex changes due to cytokine release are still a
possibility.
), are not sensitive to
atropine. Any potentials generated by any of these mechanisms
would have to be fairly rapid to be responsible for the observed
EVGs. This (and the EVG insensitivity to local anesthetics) would
probably rule out a reflex secretion or vasomotor response that
depended on transmission to the CNS and back. Reflex blood flow
changes in response to nasal irritants are clearly too slow (see
below). Reflex changes due to cytokine release are still a
possibility.
Neural responses. Irritating chemicals that stimulate the chemoreceptor nerve
endings of the nasal trigeminal system produce a neurogram potential,
detectable over wide areas of the nasal septum, that correlates
with pain sensations (Kobal, 1985![]() ; Hummel et al., 1996
; Hummel et al., 1996![]() ). The potential is strongly
reduced by local anesthetics, suggesting the involvement of
voltage-gated sodium channels, and (in rats) by capsaicin,
suggesting the involvement of small, probably nociceptive, nerve
endings. The potential clearly precedes changes in blood flow
(Thurauf et al., 1993
). The potential is strongly
reduced by local anesthetics, suggesting the involvement of
voltage-gated sodium channels, and (in rats) by capsaicin,
suggesting the involvement of small, probably nociceptive, nerve
endings. The potential clearly precedes changes in blood flow
(Thurauf et al., 1993![]() ). Whether this potential is
generated by propagation of action potentials, by depolarization of
the nerve endings, or is the consequence of rapid local cytokine action
is not clear. Whether a similar potential contributes to the EVG
is not known, although any contribution from action potential
generation (or other voltage-gated sodium channel function) seems
ruled out by the insensitivity of the EVG to local anesthetics.
The other neural system in this region of the nose that is a
candidate for the source of the EVG is the nervus terminalis. The
terminalis system is concentrated in the VNO region and has been
suggested to be chemosensory, but has not been demonstrated to be
so (Meredith and White, 1987
). Whether this potential is
generated by propagation of action potentials, by depolarization of
the nerve endings, or is the consequence of rapid local cytokine action
is not clear. Whether a similar potential contributes to the EVG
is not known, although any contribution from action potential
generation (or other voltage-gated sodium channel function) seems
ruled out by the insensitivity of the EVG to local anesthetics.
The other neural system in this region of the nose that is a
candidate for the source of the EVG is the nervus terminalis. The
terminalis system is concentrated in the VNO region and has been
suggested to be chemosensory, but has not been demonstrated to be
so (Meredith and White, 1987![]() ; Fujita et al.,
1991
; Fujita et al.,
1991![]() ). There is a reasonably high
density of unmyelinated axons in the mucosa below and near the
human VNO (Stensaas et al., 1991
). There is a reasonably high
density of unmyelinated axons in the mucosa below and near the
human VNO (Stensaas et al., 1991![]() ; Jahnke and Merker, 2000
; Jahnke and Merker, 2000![]() ), some of which could
be the unmyelinated terminal branches of trigeminal nerve fibers
or terminalis fibers, which are also generally unmyelinated. Depolarization
of nerve fibers, especially very fine fibers, generates little
extracellular potential. If fibers were in high density and all
oriented in the same direction they might be capable of producing
a potential detectable at the surface of the mucosa. Bundles
containing up to 200 nerve fibers have been reported in the nasal
mucosa, but these are not limited to the region of the VNO (Cauna
et al., 1969
), some of which could
be the unmyelinated terminal branches of trigeminal nerve fibers
or terminalis fibers, which are also generally unmyelinated. Depolarization
of nerve fibers, especially very fine fibers, generates little
extracellular potential. If fibers were in high density and all
oriented in the same direction they might be capable of producing
a potential detectable at the surface of the mucosa. Bundles
containing up to 200 nerve fibers have been reported in the nasal
mucosa, but these are not limited to the region of the VNO (Cauna
et al., 1969![]() ) and are most likely trigeminal
endings. More than one such bundle might be necessary to generate
a detectable potential, especially if the fibers did not all
respond together. The overall density of these bundles per unit
area of the mucosa was not reported by Cauna et al. and
their chemical sensitivity, if any, is completely unknown. In
general, nerve fiber endings seem unlikely as generators of a potential
like the EVG. However, the trigeminal response to irritants shows
that a system whose only peripheral components appear to be free
nerve endings can generate a surface potential, although not
necessarily by summation of individual nerve potentials alone.
Peripheral nociceptive nerve endings that are sensitive to
capsaicin, as the trigeminal potential is, are known to release substance
P, prostaglandins and possibly other cytokines (Devor, 1991
) and are most likely trigeminal
endings. More than one such bundle might be necessary to generate
a detectable potential, especially if the fibers did not all
respond together. The overall density of these bundles per unit
area of the mucosa was not reported by Cauna et al. and
their chemical sensitivity, if any, is completely unknown. In
general, nerve fiber endings seem unlikely as generators of a potential
like the EVG. However, the trigeminal response to irritants shows
that a system whose only peripheral components appear to be free
nerve endings can generate a surface potential, although not
necessarily by summation of individual nerve potentials alone.
Peripheral nociceptive nerve endings that are sensitive to
capsaicin, as the trigeminal potential is, are known to release substance
P, prostaglandins and possibly other cytokines (Devor, 1991![]() ). The actions of these substances
on surrounding tissues might contribute to the observed response.
If the EVG were found to be generated by some of the nerve endings
visible in the mucosa a process of that sort would also have to be
considered for the EVG potential.
). The actions of these substances
on surrounding tissues might contribute to the observed response.
If the EVG were found to be generated by some of the nerve endings
visible in the mucosa a process of that sort would also have to be
considered for the EVG potential.
Summary: electrical responses
It is clear that chemical species-dependent potentials could be
generated in the neighborhood of the VNO by non-vomeronasal mechanisms.
Some of these are ruled out by the nature of the EVG response or
by the controls in the published experiments, although some
important controls are not described in detail. Trigeminal nerve
endings and the components of the immune system are distributed
throughout the nose, so responses from these systems should not be
limited to the region of the VNO. Glands are localized in the
nose, including in the VNO (Stensaas et al., 1991![]() ; Trotier et al., 2000
; Trotier et al., 2000![]() ). Electroneurogram potentials
similar to those from the trigeminal system could also appear more
localized if there were a concentration of nerve endings in or
near the VNO. Contributions from the trigeminal potential itself
seem unlikely because it has a different susceptibility to local
anesthetics and because the trigeminal system certainly responds
to irritating chemicals over a wider area. Nervus terminalis endings
are localized to the VNO, but their chemosensitivity is
questionable. The report that local anesthetics fail to block the
EVG indicates that nerve transmission is not involved, which rules
out CNS reflexes. A local response mediated by cytokines is not
ruled out. The other possibility is a direct response from cells
expressing receptors for the effective chemicals, whether VNO
sensory neurons, trigeminal or terminalis nerve endings,
non-neural secretory cells or others. Any cellular components
capable of generating a detectable potential would have to be
clustered and have a common orientation for their individual
potentials to sum. VNO sensory neurons, if these are limited to
the NSE-expressing bipolar cells, are unlikely candidates because
of their sparseness, even if one believes that these cells are
VSNs.
). Electroneurogram potentials
similar to those from the trigeminal system could also appear more
localized if there were a concentration of nerve endings in or
near the VNO. Contributions from the trigeminal potential itself
seem unlikely because it has a different susceptibility to local
anesthetics and because the trigeminal system certainly responds
to irritating chemicals over a wider area. Nervus terminalis endings
are localized to the VNO, but their chemosensitivity is
questionable. The report that local anesthetics fail to block the
EVG indicates that nerve transmission is not involved, which rules
out CNS reflexes. A local response mediated by cytokines is not
ruled out. The other possibility is a direct response from cells
expressing receptors for the effective chemicals, whether VNO
sensory neurons, trigeminal or terminalis nerve endings,
non-neural secretory cells or others. Any cellular components
capable of generating a detectable potential would have to be
clustered and have a common orientation for their individual
potentials to sum. VNO sensory neurons, if these are limited to
the NSE-expressing bipolar cells, are unlikely candidates because
of their sparseness, even if one believes that these cells are
VSNs.
Importance of the EVG response
Whatever the source, the reported selectivity of the EVG response is
startling. It represents information that, if conveyed to the CNS,
could serve a communication function. If the EVG is generated by
primary sensory neurons or afferent nerve terminals, the
connection pathway to the CNS is obvious and a contribution to
chemical communication is likely. If the EVG is generated by
secretory cells or other purely peripheral cells the CNS connection
is not clear and a contribution to chemical communication more
dubious. In either case, EVGs are probably not generated directly
by the bipolar cells that express NSE. Perhaps other cells in the
human VNO are VSNs with the appropriate sensitivity and geometry,
but, if so, they are yet unrecognized.
Best case:
The local electrical response is from VNO region chemosensory
cells, but these are unlikely to be the too-sparse bipolar cells.
Systemic responses to stimulation restricted to the VNO pit
constitute physiological evidence for a chemosensory function in
this region
Worst case:
(Speculative) The local response is an artifact, albeit
surprisingly dependent on the nature of the stimulus, perhaps
because of electrode movement between stimulations. Alternatively,
the response could be from non-chemosensory cells with no
connections to the brain. Systemic responses could be due to
leakage of stimuli to the olfactory area.
Opinion:
The EVG is the best evidence for a selective chemosensory process
in the VNO region. Systemic responses to restricted VNO region
stimulation are an important stumbling block for the hypothesis
that there is no special chemosensitivity in this region.
|
|
Function:
evidence from chemical communication? |
There is fairly clear evidence for chemical communication among humans.
The most notable example is a trend towards synchronization of
menstrual cycles in women who live together (McClintock, 1971![]() ). Stern and McClintock have
recently deduced the presence of two substances that can mediate
this response when extracts of skin secretions are placed on the
upper lip (Stern and McClintock, 1998
). Stern and McClintock have
recently deduced the presence of two substances that can mediate
this response when extracts of skin secretions are placed on the
upper lip (Stern and McClintock, 1998![]() ). Thus, the signals are most
likely to be airborne chemicals. The trend towards synchronization
arises from either shortening or lengthening of the cycle by
secretions produced at different phases of the donor’s cycle [but
see the comment by Whitten (Whitten, 1999
). Thus, the signals are most
likely to be airborne chemicals. The trend towards synchronization
arises from either shortening or lengthening of the cycle by
secretions produced at different phases of the donor’s cycle [but
see the comment by Whitten (Whitten, 1999![]() )]. The substances involved are
unknown and although the effect does appear to be chemosensory,
there is no evidence that it is due to vomeronasal sensory input.
Jacob and McClintock have also recently reported a human
behavioral response to odor; changes in mood elicited by
androstadienone and 1,3,5(10)16 estratetraen-3-ol (Jacob and
McClintock, 2000
)]. The substances involved are
unknown and although the effect does appear to be chemosensory,
there is no evidence that it is due to vomeronasal sensory input.
Jacob and McClintock have also recently reported a human
behavioral response to odor; changes in mood elicited by
androstadienone and 1,3,5(10)16 estratetraen-3-ol (Jacob and
McClintock, 2000![]() ). These are substances that
elicit sexually dimorphic EVGs and are related to skin chemicals
claimed to be human pheromones. Jacob and McClintock report the
maintenance of a more positive mood in women in the presence of
androstadienone under circumstances where control subjects showed
an increasingly negative mood. The response cannot be attributed
to the vomeronasal system because the stimuli were placed on the
upper lip, not confined to the VNO. Grosser et al. also
report significantly less negative mood in subjects exposed to
androstadienone than in control subjects (Grosser et al.,
2000
). These are substances that
elicit sexually dimorphic EVGs and are related to skin chemicals
claimed to be human pheromones. Jacob and McClintock report the
maintenance of a more positive mood in women in the presence of
androstadienone under circumstances where control subjects showed
an increasingly negative mood. The response cannot be attributed
to the vomeronasal system because the stimuli were placed on the
upper lip, not confined to the VNO. Grosser et al. also
report significantly less negative mood in subjects exposed to
androstadienone than in control subjects (Grosser et al.,
2000![]() ). In their experiments
androstadienone was applied directly to the VNO, a much better
case for vomeronasal mediation. However, as with the EVG,
responses due to stimulation in the region of the VNO are not
necessarily mediated by VSNs.
). In their experiments
androstadienone was applied directly to the VNO, a much better
case for vomeronasal mediation. However, as with the EVG,
responses due to stimulation in the region of the VNO are not
necessarily mediated by VSNs.
Whether
any of these findings are evidence for human pheromones is a
different question. None of them meet the test for pheromone communication
proposed below, i.e. evidence that the communication is beneficial
(in the evolutionary sense) to both sender and receiver. The
subjects in these studies had no conscious perception of odor stimulation,
which could be a feature of vomeronasal input although not a sine
qua non for pheromonal communication. The suggestion that
vomeronasal input might be unconscious (Lloyd-Thomas and Keverne,
1982![]() ) comes in part from observations
of vomeronasal system connections in the rodent brain. There are
close connections with the amygdala and limbic system (Halpern,
1987
) comes in part from observations
of vomeronasal system connections in the rodent brain. There are
close connections with the amygdala and limbic system (Halpern,
1987![]() ; Meredith, 1991
; Meredith, 1991![]() ), the seat of emotional, hormonal
and autonomic control, but there are only indirect connections
with the cerebral cortex, generally considered to be the site of
consciousness. The main olfactory system in general has good
connections with cerebral cortex, but also has connections to the
amygdala. In hamsters pheromonal information from the main
olfactory system in sexually experienced animals appears to be
transferred to the vomeronasal pathway at the amygdala (Meredith,
1998
), the seat of emotional, hormonal
and autonomic control, but there are only indirect connections
with the cerebral cortex, generally considered to be the site of
consciousness. The main olfactory system in general has good
connections with cerebral cortex, but also has connections to the
amygdala. In hamsters pheromonal information from the main
olfactory system in sexually experienced animals appears to be
transferred to the vomeronasal pathway at the amygdala (Meredith,
1998![]() ). In this case the olfactory
information appears to be a back-up for a primary vomeronasal communication
system. However, in the cases where main olfactory input is the
only important information on pheromones we still have no idea
whether information about main olfactory pheromones has access to
the cortex or is routed through the amygdala and basal forebrain.
Thus, a chemosensory communication that does not engage consciousness,
if it could be proven, is not diagnostic for vomeronasal
participation. A chemosensory response in the human brain without
any conscious perception of stimulation has been identified by
fMRI using another ‘vomeropherin’ steroid, estra-1,3,5(10)
tetraen-3-yl acetate, related to substances extracted from human
skin (Sobel et al., 1999
). In this case the olfactory
information appears to be a back-up for a primary vomeronasal communication
system. However, in the cases where main olfactory input is the
only important information on pheromones we still have no idea
whether information about main olfactory pheromones has access to
the cortex or is routed through the amygdala and basal forebrain.
Thus, a chemosensory communication that does not engage consciousness,
if it could be proven, is not diagnostic for vomeronasal
participation. A chemosensory response in the human brain without
any conscious perception of stimulation has been identified by
fMRI using another ‘vomeropherin’ steroid, estra-1,3,5(10)
tetraen-3-yl acetate, related to substances extracted from human
skin (Sobel et al., 1999![]() ). Vomeronasal involvement
in this response is unknown, since the stimulus was not confined
to the organ.
). Vomeronasal involvement
in this response is unknown, since the stimulus was not confined
to the organ.
Other
examples of potential chemosensory communication are discussed by
Preti and Wysocki in a comprehensive review (Preti and Wysocki, 1999![]() ). They conclude that chemical
communication does occur and are willing to call the chemical
mediators pheromones in some cases. Preti and Wysocki’s
conclusions are based on specific examples, but a similar
conclusion would not be outrageous on basic principles.
Intra-specific chemical communication, some of which is vomeronasal
and some olfactory, is a common feature in land mammals. Higher
primates have highly developed visual systems and reduced
olfactory systems, but still use olfactory information. It would
seem surprising if all olfactory/chemosensory communication were
lost. The fact that chemical communication does not seem to be a
strong determinant of human behavior is not a good logical
argument for dismissing vomeronasal function, as seems to be
implied by Keverne (Keverne, 1999
). They conclude that chemical
communication does occur and are willing to call the chemical
mediators pheromones in some cases. Preti and Wysocki’s
conclusions are based on specific examples, but a similar
conclusion would not be outrageous on basic principles.
Intra-specific chemical communication, some of which is vomeronasal
and some olfactory, is a common feature in land mammals. Higher
primates have highly developed visual systems and reduced
olfactory systems, but still use olfactory information. It would
seem surprising if all olfactory/chemosensory communication were
lost. The fact that chemical communication does not seem to be a
strong determinant of human behavior is not a good logical
argument for dismissing vomeronasal function, as seems to be
implied by Keverne (Keverne, 1999![]() ), anymore than it is
for dismissing olfactory function. Sensory input of any kind in
humans, unless signaling imminent danger, is often subordinate to
experiential and cultural factors. Chemical communication does
appear to persist despite its apparently minor impact. Stoddart
has proposed that there might be evolutionary pressure for loss of
human vomeronasal function (Stoddart, 1991
), anymore than it is
for dismissing olfactory function. Sensory input of any kind in
humans, unless signaling imminent danger, is often subordinate to
experiential and cultural factors. Chemical communication does
appear to persist despite its apparently minor impact. Stoddart
has proposed that there might be evolutionary pressure for loss of
human vomeronasal function (Stoddart, 1991![]() ). He speculates that
it was important for males in early hominid groups not to
be able to detect the time of ovulation in females. Whatever its
anthropological merit, this argument is logically circular in the
context of an evaluation of VNO function because it starts with
the premise that there is no human VNO. It also assumes that
detection of ‘pheromones’ signaling reproductive state would be a
vomeronasal function.
). He speculates that
it was important for males in early hominid groups not to
be able to detect the time of ovulation in females. Whatever its
anthropological merit, this argument is logically circular in the
context of an evaluation of VNO function because it starts with
the premise that there is no human VNO. It also assumes that
detection of ‘pheromones’ signaling reproductive state would be a
vomeronasal function.
Among
species where some chemical communication can be assigned to the
vomeronasal sensory pathway there are a number of examples where
the signals appear to be non-volatile and to be transmitted by
direct contact between receiver and stimulus source (Meredith, 1983![]() ; Clancy et al., 1984
; Clancy et al., 1984![]() ). However, there is no
requirement that vomeronasal chemoreceptors be stimulated only by
non-volatile chemicals. Nor would the demonstration of a
non-volatile chemical signal be any assurance that the vomeronasal
system were involved.
). However, there is no
requirement that vomeronasal chemoreceptors be stimulated only by
non-volatile chemicals. Nor would the demonstration of a
non-volatile chemical signal be any assurance that the vomeronasal
system were involved.
Best/worst cases: There is nothing to be learned about vomeronasal function, whether in humans or other species, from the existence of chemical communication per se or from its features, such as involvement of volatile versus non-volatile chemicals or the access of information to consciousness. There are other sensory systems that could be involved.
|
|
Pheromones |
What is a pheromone and is it a well-defined, scientifically useful
concept? The term pheromone was coined to describe a chemical
substance which carries a message about the physiological or
behavioral state of an insect to members of its own species, resulting
in ‘a specific reaction, for example a definite behaviour or a
developmental process’ (Karlson and Luscher, 1959![]() ). It is clear in the original
description, and in a later more extensive review of examples
(Karlson and Butenandt, 1959
). It is clear in the original
description, and in a later more extensive review of examples
(Karlson and Butenandt, 1959![]() ), that this was to be
real communication, beneficial to the sender and, by implication,
to the receiver. Karlson and Luscher state: ‘the organism . . .
creates for itself a means of communication . . .’ (Karlson and
Luscher, 1959
), that this was to be
real communication, beneficial to the sender and, by implication,
to the receiver. Karlson and Luscher state: ‘the organism . . .
creates for itself a means of communication . . .’ (Karlson and
Luscher, 1959![]() ). We can be sure that the
authors did not mean that the individual organism created this
capacity, but that it was established and maintained by natural
selection. This would require that the communication contributed
to evolutionary ‘fitness’ for both sender and receiver. If this
mutual benefit requirement is included as an explicit part of the
definition (Rutowski, 1981
). We can be sure that the
authors did not mean that the individual organism created this
capacity, but that it was established and maintained by natural
selection. This would require that the communication contributed
to evolutionary ‘fitness’ for both sender and receiver. If this
mutual benefit requirement is included as an explicit part of the
definition (Rutowski, 1981![]() ; Meredith, 1983
; Meredith, 1983![]() ), the application of the term
becomes more restricted but more scientifically useful. Many
examples of ‘a specific reaction’ to biological chemicals are then
excluded from the category of ‘pheromone communications’. Among
these non-pheromone responses are intra-specific predation and chemical
defense, where there is clear benefit either only to the receiver
or only to the sender. Inter-specific communication could be
mutually beneficial, for example where chemosensory information
about defense chemicals benefits the receiver by allowing
avoidance. Nevertheless, there seems to be some advantage to our
communication in arbitrarily limiting the term pheromone to
intra-specific communication.
), the application of the term
becomes more restricted but more scientifically useful. Many
examples of ‘a specific reaction’ to biological chemicals are then
excluded from the category of ‘pheromone communications’. Among
these non-pheromone responses are intra-specific predation and chemical
defense, where there is clear benefit either only to the receiver
or only to the sender. Inter-specific communication could be
mutually beneficial, for example where chemosensory information
about defense chemicals benefits the receiver by allowing
avoidance. Nevertheless, there seems to be some advantage to our
communication in arbitrarily limiting the term pheromone to
intra-specific communication.
Following
Karlson and Luscher’s suggestion that responses could be
behavioral or developmental, later authors have classified pheromone
communications into two types: priming pheromones and releasing or
signaling pheromones.
Priming
pheromones produce a change of state in the receiver, usually a
change in hormonal secretion that primes the animal for a later
response. Examples include the acceleration of puberty in immature
female mice that brings them into reproductive condition in the
presence of chemical signals from mature males (Vandenberg, 1983![]() ). In this case the mutual benefit
is clear, and a good case can be made for many other priming
pheromonal communications in mice. The mutual suppression of
estrus in group housed females (the ‘Lee–Boot Effect’) (van der
Lee and Boot, 1955
). In this case the mutual benefit
is clear, and a good case can be made for many other priming
pheromonal communications in mice. The mutual suppression of
estrus in group housed females (the ‘Lee–Boot Effect’) (van der
Lee and Boot, 1955![]() ) conserves the energy normally
put into cycling when there is no possibility of pregnancy. A
suppression of estrus also occurs in fasting females where energy
conservation is essential (Wade and Schneider, 1992
) conserves the energy normally
put into cycling when there is no possibility of pregnancy. A
suppression of estrus also occurs in fasting females where energy
conservation is essential (Wade and Schneider, 1992![]() ). In the presence of male
stimuli, group housed females return to estrus cycling (the
‘Whitten Effect’) (Whitten, 1959
). In the presence of male
stimuli, group housed females return to estrus cycling (the
‘Whitten Effect’) (Whitten, 1959![]() ), clearly a mutually beneficial
response. Reproductive suppression in subordinate females, as may
occur in some primate species (Barrett et al., 1993
), clearly a mutually beneficial
response. Reproductive suppression in subordinate females, as may
occur in some primate species (Barrett et al., 1993![]() ), may also involve a
conservation of metabolic effort until more favorable circumstances
arise. In cases where the subordinate and dominant females are
genetically related there might be some increase in inclusive
fitness (inclusive fitness takes into account an individual’s
contribution to the reproductive success of related individuals
that carry some of the same genes).
), may also involve a
conservation of metabolic effort until more favorable circumstances
arise. In cases where the subordinate and dominant females are
genetically related there might be some increase in inclusive
fitness (inclusive fitness takes into account an individual’s
contribution to the reproductive success of related individuals
that carry some of the same genes).
The
other class of pheromones, releasing pheromones, were originally considered
to release a stereotyped behavioral pattern that required no
further information for its completion. This concept seemed
inappropriate for mammals, where responses are often modified by
experience or other contingencies, and behavioral responses are
now said to be elicited by ‘signaling’ pheromones (Bronson, 1971![]() , 1976
, 1976![]() ; Albone, 1984
; Albone, 1984![]() ).
).
Preti
and Wysocki examined reports of human pheromone communication. They
concluded that there is evidence for priming pheromones in humans,
including the data on menstrual cycle shifts (although the latter
do not clearly meet the mutual benefit criterion proposed here)
(Preti and Wysocki, 1999![]() ). They did not find solid
evidence for signaling pheromones but they point out that mammalian,
and especially human, behavior is influenced by many factors. An
immediate unvarying response to any stimulus should not be
expected. Thus, signaling pheromones might communicate information
that alters an individual’s probability of responding without
necessarily evoking an immediate observable response. Perhaps we
don’t need to distinguish categorically between priming and
signaling communications: both are essentially informational.
Furthermore, if we concentrate on pheromone communication rather
than pheromone chemicals, we avoid definitional problems associated
with chemicals that have different meanings in different contexts
or to different individuals, for example mature versus immature or
male versus female. The fact that the same chemicals may be used
by different species, whether or not in different combinations or
different circumstances, is also not a problem.
). They did not find solid
evidence for signaling pheromones but they point out that mammalian,
and especially human, behavior is influenced by many factors. An
immediate unvarying response to any stimulus should not be
expected. Thus, signaling pheromones might communicate information
that alters an individual’s probability of responding without
necessarily evoking an immediate observable response. Perhaps we
don’t need to distinguish categorically between priming and
signaling communications: both are essentially informational.
Furthermore, if we concentrate on pheromone communication rather
than pheromone chemicals, we avoid definitional problems associated
with chemicals that have different meanings in different contexts
or to different individuals, for example mature versus immature or
male versus female. The fact that the same chemicals may be used
by different species, whether or not in different combinations or
different circumstances, is also not a problem.
It
can be argued (Beauchamp et al., 1976![]() ) that there is no need for
a special term for mutually beneficial chemical communication, but,
as emphasized by Karlson and Luscher (Karlson and Luscher, 1959
) that there is no need for
a special term for mutually beneficial chemical communication, but,
as emphasized by Karlson and Luscher (Karlson and Luscher, 1959![]() ), some distinction between
communication and a casual use of chemosensory information does
seem a useful distinction. The term pheromone is not going to
disappear so long as it holds the public fascination. Its use for
a class of chemicals that communicate information seems
reasonable, but the definition is important if the term is to be
useful in scientific discourse. Too rigid a definition can make
its applicability to real situations so limited that it is
useless. We know that even archetypal insect pheromones are not
unique chemicals used by single species, as supposed in some
definitions [see discussions in Beauchamp et al. and Albone
(Beauchamp et al., 1976
), some distinction between
communication and a casual use of chemosensory information does
seem a useful distinction. The term pheromone is not going to
disappear so long as it holds the public fascination. Its use for
a class of chemicals that communicate information seems
reasonable, but the definition is important if the term is to be
useful in scientific discourse. Too rigid a definition can make
its applicability to real situations so limited that it is
useless. We know that even archetypal insect pheromones are not
unique chemicals used by single species, as supposed in some
definitions [see discussions in Beauchamp et al. and Albone
(Beauchamp et al., 1976![]() ; Albone, 1984
; Albone, 1984![]() )]. Similarly, too
broad a definition devalues the term and also makes it useless.
)]. Similarly, too
broad a definition devalues the term and also makes it useless.
The
essence of the concept is that a particular chemical or complex of
chemicals communicates meaning and, thus, must be identified.
Non-specialist functions of mammalian olfactory systems may
involve a simple association between a complex of chemicals and an
external situation, permitting later recognition of similar
situations. Particular chemicals may be associated with particular
objects, but there may be no necessity for the chemicals to be
identified, and the associations can be reassigned. This mechanism
is less suitable for communication where the messages have special
meanings. Preprogrammed meaning may be assigned to odors in other contexts,
especially in invertebrates, where individuals may be adapted to
finding and consuming host plants using specialized receptors
(Rostelien et al., 2000![]() ). These are not
pheromone communications because they are not mutually beneficial
and not intra-specific. Odor communication between flowers and
pollinating insects is mutually beneficial, but I would not label
it pheromonal because it occurs across species, even though its
evolutionary mechanisms may be similar to those maintaining
intra-specific mutually beneficial communication.
). These are not
pheromone communications because they are not mutually beneficial
and not intra-specific. Odor communication between flowers and
pollinating insects is mutually beneficial, but I would not label
it pheromonal because it occurs across species, even though its
evolutionary mechanisms may be similar to those maintaining
intra-specific mutually beneficial communication.
The
mutual benefit criterion for pheromone communication does not
exclude learned responses, especially the imprinting type, where
meaning is assigned in some special circumstance. It does imply
that meaning is not infinitely reassignable; that it is not just
an association even though there are instances where arbitrary
odors can be substituted for preprogrammed stimuli. For example,
newborn rabbits exposed to a commercial perfume in association
with their first feeding can use the odor as information to elicit
the nipple search behavior normally elicited by the mother’s
nipple pheromone (Hudson, 1985![]() ). In this case the
chemical is not a pheromone although a response normally elicited
by pheromonal communication has been linked to it by conditioning.
The response to the natural pheromone does not require
conditioning. The plasticity of the mammalian nervous system in the
assignment of input/output routing extends to normally stereotyped
relationships such as these responses or the eye blink, which is
normally elicited by an air puff but can be conditioned to a tone.
). In this case the
chemical is not a pheromone although a response normally elicited
by pheromonal communication has been linked to it by conditioning.
The response to the natural pheromone does not require
conditioning. The plasticity of the mammalian nervous system in the
assignment of input/output routing extends to normally stereotyped
relationships such as these responses or the eye blink, which is
normally elicited by an air puff but can be conditioned to a tone.
The
mutual benefit criterion for pheromones also does not exclude emotional
(mood) changes as a valid response, even if these do not
immediately affect overt behavior. We know that in humans mood can
affect future behavior (a sign of information transfer) and
reliable biases in behavior could have evolutionary consequences. On
the other hand, a change of mood on exposure to a human-derived chemical
(Grosser et al., 2000![]() ; Jacob and McClintock, 2000
; Jacob and McClintock, 2000![]() ) does not adequately
define a pheromone. There are many biological chemicals that can
be expected to evoke behavioral and mood changes. Some of these
responses, such as avoidance and disgust with fecal and body
odors, may be culturally determined. Some benefit to the receiver
in avoiding parasite transmission may be associated with avoidance
of fecal odors, but a similar benefit with respect to general body
odors is less likely, and a benefit to the sender in either case
seems doubtful if no definite message is transmitted.
) does not adequately
define a pheromone. There are many biological chemicals that can
be expected to evoke behavioral and mood changes. Some of these
responses, such as avoidance and disgust with fecal and body
odors, may be culturally determined. Some benefit to the receiver
in avoiding parasite transmission may be associated with avoidance
of fecal odors, but a similar benefit with respect to general body
odors is less likely, and a benefit to the sender in either case
seems doubtful if no definite message is transmitted.
Identifying
mutual benefit in a given case is not always easy, but the
criterion provides a conceptual framework for understanding the
establishment of a chemical communication. If there is no communication
there seems no reason to use a special term. Where a mutual
advantage does not seem reasonable, communication is suspect.
Whatever
the definition of pheromone, there is no evidence that pheromones
are necessarily detected by the VNO. Several recent examples in
animals with well-developed VNOs make this clear. The response of
newborn rabbits to the mother’s nipple (Hudson and Distel, 1986![]() ), referred to above, and the
standing response of a receptive female pig to the male’s
pheromone (Dorries et al., 1997
), referred to above, and the
standing response of a receptive female pig to the male’s
pheromone (Dorries et al., 1997![]() ) both depend on the main
olfactory system. The recognition of newborn lambs by ewes also
appears to depend on the main olfactory system (Levy et al.,
1995
) both depend on the main
olfactory system. The recognition of newborn lambs by ewes also
appears to depend on the main olfactory system (Levy et al.,
1995![]() ), although a vomeronasal
contribution has also been reported (Booth and Katz, 2000
), although a vomeronasal
contribution has also been reported (Booth and Katz, 2000![]() ). Thus, even if an authentic
pheromone response were to be documented in humans, that would not
be evidence for a functional VNO.
). Thus, even if an authentic
pheromone response were to be documented in humans, that would not
be evidence for a functional VNO.
Furthermore,
one of the prime examples of main olfactory pheromones, nipple
search behavior in rabbits, appears not to be learned, although
the same response pattern can be conditioned to arbitrary odors. A
ewe’s recognition of her lamb is learned during the first few
hours after parturition. The recognition of a mate’s pheromone
signature in the pregnancy block or ‘Bruce effect’ in mice also
appears to be learned, but this is a vomeronasal process. It may
well be in both of these cases that the learning involved is
imprinting of a particular combination from a limited set of
signals. Nevertheless, we cannot use the preprogrammed unlearned
nature of a response to a chemical signal as diagnostic of
vomeronasal involvement.
Best case:
The existence of a functional VNO in humans would not be ruled out
either by the presence or the absence of pheromone communication
in humans nor, if present, by any of its features, such as learned
versus unlearned responses.
Worst case:
Vomeronasal function is not necessary to explain any aspect of
chemical communication in humans, nor is it necessary for
pheromonal communication.
Opinion:
The term ‘pheromone’ is useful if defined in the context of
mutually beneficial pheromonal communication. Chemical
communication occurs in humans. Whether it is pheromonal in this
sense remains to be established. The presence or absence of
pheromones and pheromonal communication is independent of the
existence and/or functionality of a human VNO.
|
|
Summary: evidence for human vomeronasal function |
Best case: VNO is a minor but not insignificant contributor to
human communication. More work by independent groups is needed to
confirm the reported electrical and hormonal responses. The expression
of a vomeronasal-type receptor gene in humans raises the possibility
that such genes may underlie chemosensitivity in the vomeronasal
region.
Worst case:
The VNO is absent or if present is not chemosensitive nor
necessarily functional in communication. The evidence for chemosensitivity
is poorly documented and has not all been subject to effective
peer review. The evidence for a communication function could be
artifactual.
Opinion:
The EVG constitutes evidence for a selective and sensitive response
to human-derived chemicals located in the region of the VNO.
Systemic autonomic responses and emotional changes elicited by
stimulation in this region suggest some chemosensitivity, even
though the anatomical substrate is difficult to demonstrate and
seems unlikely to be conventional VSNs. If we didn’t have the
positive evidence from EVG, autonomic and psychological responses,
reasonable scientific judgment would assign the role of detecting
human-derived chemicals that might be involved in chemical
communication to the main olfactory system. However, ignoring the
evidence for vomeronasal function because most of it comes with
commercial baggage is not a rational scientific response in the
absence of evidence for error, bias or fraud. An independent
investigation is required to test the findings and assumptions of
the original reports, with the appropriate controls and a full
description of experimental details. This cannot be done within
the pages of this or any journal. It requires laboratory time.